题目内容
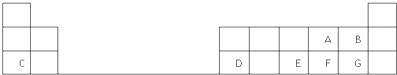
下表列出了A~R十种元素在周期表的位置:
(1)R单质分子的电子式 ;
(2)A、C、D三种元素的氧化物对应的水化物中,碱性最强的是(填化学式) .
(3)A、B、C三种元素的原子半径由大到小的顺序排列为 (用元素符号表示).
(4)A的单质与水反应的化学方程式 .
(5)I、G、E三种元素的氢化物的还原性由强到弱的顺序是(填化学式) .
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | R | F | I | |||||
| 3 | A | C | D | H | G | |||
| 4 | B | E |
(2)A、C、D三种元素的氧化物对应的水化物中,碱性最强的是(填化学式)
(3)A、B、C三种元素的原子半径由大到小的顺序排列为
(4)A的单质与水反应的化学方程式
(5)I、G、E三种元素的氢化物的还原性由强到弱的顺序是(填化学式)
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、H为Si、R为氮、F为氧、I为氟、G为Cl、E为Br.
(1)氮气分子中N原子之间形成3对共用电子对;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)钠与水反应生成氢氧化钠与氢气;
(5)同主族自上而下非金属性减弱,氢化物还原性增强.
(1)氮气分子中N原子之间形成3对共用电子对;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)钠与水反应生成氢氧化钠与氢气;
(5)同主族自上而下非金属性减弱,氢化物还原性增强.
解答:
解:由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、H为Si、R为氮、F为氧、I为氟、G为Cl、E为Br.
(1)氮气分子中N原子之间形成3对共用电子对,电子式为: ,故答案为:
,故答案为: ;
;
(2)同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH进行最强,故答案为:NaOH;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,故答案为:K>Na>Mg;
(4)钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(5)同主族自上而下非金属性减弱,非金属性越弱,氢化物还原性越强,故氢化物还原性:HBr>HCl>HF,故答案为:HBr>HCl>HF.
(1)氮气分子中N原子之间形成3对共用电子对,电子式为:
 ,故答案为:
,故答案为: ;
;(2)同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH进行最强,故答案为:NaOH;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,故答案为:K>Na>Mg;
(4)钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(5)同主族自上而下非金属性减弱,非金属性越弱,氢化物还原性越强,故氢化物还原性:HBr>HCl>HF,故答案为:HBr>HCl>HF.
点评:本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律的考查,注意对基础知识理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列化合物的沸点由高到低的顺序正确的是( )
①CH3CH2CH2CH2Cl ②CH3CH2CH2CH2Br ③CH3CH(CH3)CH2Cl ④CH3CH2CH2CH3.
①CH3CH2CH2CH2Cl ②CH3CH2CH2CH2Br ③CH3CH(CH3)CH2Cl ④CH3CH2CH2CH3.
| A、②①④③ | B、②④①③ |
| C、②①③④ | D、①③②④ |
由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20.下列说法中正确的是( )
| A、化合物中阳离子和阴离子的个数不一定相等 |
| B、化合物中一定只有离子键没有共价键 |
| C、所含元素一定不在同一周期也不在第一周期 |
| D、化合物中阳离子半径一定大于阴离子半径 |
下列说法正确的是( )
| A、可以用稀硝酸和BaCl2溶液检验Na2SO3是否变质 |
| B、可以用碳酸钠溶液除去CO2中的SO2 |
| C、可以用NaOH溶液区别NH4Cl、Al2(SO4)3、CuSO4、FeCl3区别开 |
| D、某溶液中加入BaCl2溶液变浑浊,则此溶液中一定含有CO32? |