题目内容
(1)取少量Fe2O3粉末(红棕色)加入适量盐酸制得溶液,所发生反应的离子方程式为 ,用此溶液进行以下实验.
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸直至溶液呈 色,即可制得Fe(OH)3胶体.
(3)取少量Fe(OH)3胶体置于试管中,向试管中滴加一定量HI稀溶液(已知HI是一种具有强还原性的强酸),边滴边振荡,会出现一系列变化.
①先出现红褐色沉淀,原因是 .
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式 .
③最后溶液颜色加深,原因是 (用离子方程式表示)
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸直至溶液呈
(3)取少量Fe(OH)3胶体置于试管中,向试管中滴加一定量HI稀溶液(已知HI是一种具有强还原性的强酸),边滴边振荡,会出现一系列变化.
①先出现红褐色沉淀,原因是
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式
③最后溶液颜色加深,原因是
考点:离子方程式的书写,胶体的重要性质
专题:离子反应专题,元素及其化合物
分析:(1)Fe2O3粉末与盐酸反应生成氯化铁和水;
(2)依据氢氧化铁胶体的制备解答;
(3)①依据胶体聚沉的性质解答;
②氢氧化铁与氢碘酸发生酸碱中和反应;
③三价铁离子具有强的氧化性,能够氧化碘离子.
(2)依据氢氧化铁胶体的制备解答;
(3)①依据胶体聚沉的性质解答;
②氢氧化铁与氢碘酸发生酸碱中和反应;
③三价铁离子具有强的氧化性,能够氧化碘离子.
解答:
解:(1)Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式:Fe2O3+6H+═2Fe3++3H2O;
故答案为:Fe2O3+6H+═2Fe3++3H2O;
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸得到透明的红褐色的氢氧化铁胶体分散系;
故答案为:红褐色;
(3)①碘化氢为可溶性电解质,能够使氢氧化铁胶体发生聚沉,出现红褐色沉淀;
故答案为:加入电解质后,胶体发生聚沉;
②氢氧化铁与氢碘酸发生酸碱中和反应:Fe(OH)3+3H+═Fe3++3H2O,所以沉淀溶解,溶液呈黄色;
故答案为:Fe(OH)3+3H+═Fe3++3H2O;
③三价铁离子具有强的氧化性,能够氧化碘离子,生成单质碘,反应的离子方程式为:2Fe3++2I-═I2+2Fe2+,所以最后溶液颜色加深;
故答案为:2Fe3++2I-═I2+2Fe2+.
故答案为:Fe2O3+6H+═2Fe3++3H2O;
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸得到透明的红褐色的氢氧化铁胶体分散系;
故答案为:红褐色;
(3)①碘化氢为可溶性电解质,能够使氢氧化铁胶体发生聚沉,出现红褐色沉淀;
故答案为:加入电解质后,胶体发生聚沉;
②氢氧化铁与氢碘酸发生酸碱中和反应:Fe(OH)3+3H+═Fe3++3H2O,所以沉淀溶解,溶液呈黄色;
故答案为:Fe(OH)3+3H+═Fe3++3H2O;
③三价铁离子具有强的氧化性,能够氧化碘离子,生成单质碘,反应的离子方程式为:2Fe3++2I-═I2+2Fe2+,所以最后溶液颜色加深;
故答案为:2Fe3++2I-═I2+2Fe2+.
点评:本题考查了强氧化铁胶体的制备和性质,题目难度不大,书写胶体的性质是解题关键,注意离子方程式的书写.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、3.4g NH3中含N-H键数目为0.2NA |
| B、1L 0.1mol?L-1 HClO溶液中H+数为0.1NA |
| C、标准状况下,22.4L C2H5OH中含有的氢原子数为6NA |
| D、常温常压下,92g的NO2和N2O4混合气体含有的原子总数为6NA |
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、在密闭容器中,使1mol N2与3mol H2充分反应后生成NH3的分子数为2NA |
| B、标准状况下,4.48L N2中含有的共用电子对数为0.2NA |
| C、常温常压下,1mol NaHSO4晶体中含有的离子总数为2NA |
| D、标准状况下,1mol Fe与2.24L Cl2完全反应后转移的电子数为3NA |
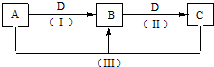 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题:
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题: