题目内容
5.现有下列短周期元素性质的有关数据:| 元素符号 | a | b | c | d | e | f | g | h |
| 原子半径/mm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合计 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
| 族/周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛.在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH).
①氢化铝锂易水解,最初得三种产物,请写出其水解反应方程式LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑.
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请写出这种还原剂的电子式.写出该物质受热分解的反应方程式:2NaBH4$\frac{\underline{\;\;△\;\;}}{\;}$2B+2NaH+3H2↑.
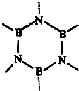
(4)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,写出“白石墨”的最小结构单元-六元环的结构式
 .
.
分析 短周期元素中,a、g、h的最高价都是+1价,则三者位于ⅠA族,根据原子半径大小可知a为H、b为Li、h为Na;d、f最高价都是+3,则d为B、f为Al;e最低价为-2,其原子半径大于B,则e不可能为O,只能为S元素;b的最低价为-1,处于ⅦA,原子半径小于B元素,故b为F元素;c有最低负极-3,处于ⅤA族,原子半径小于B原子,故c为N元素,据此进行解答.
解答 解:(1)短周期元素中,a、g、h的最高价都是+1价,则三者位于ⅠA族,根据原子半径大小可知a为H、b为Li、h为Na;d、f最高价都是+3,则d为B、f为Al;e最低价为-2,其原子半径大于B,则ee不可能为O,只能为S元素;b的最低价为-1,处于ⅦA,原子半径小于B元素,故b为F元素;c有最低价-3,处于ⅤA族,原子半径小于B原子,故c为N元素,将各元素填入表中为:
| 族/周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | g | d | c | b | ||||
| 3 | h | f | e |
故答案为:
| 族/周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | g | d | c | b | ||||
| 3 | h | f | e |
故答案为:HF、NH3;
(3)①氢化铝锂易水解,最初得三种产物,根据质量守恒得到三种产物为LiOH、Al(OH)3和氢气,反应的化学方程式为:LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑,
故答案为:LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑;
②氢化铝锂(LiAlH4)在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH),与氢化铝锂性质相似但较温和的另一种还原剂由上述H、B、Na三种元素组成物质为NaBH4,分解生成氢气、B与NaH,反应方程式为:2NaBH4$\frac{\underline{\;\;△\;\;}}{\;}$2B+2NaH+3H2↑,NaBH4为离子化合物,其电子式为:
 ,
,故答案为:
 ;2NaBH4$\frac{\underline{\;\;△\;\;}}{\;}$2B+2NaH+3H2↑;
;2NaBH4$\frac{\underline{\;\;△\;\;}}{\;}$2B+2NaH+3H2↑;(4)石墨晶体是层面结构的,每个C为三个正六边形共用,每六个C原子形成一个正六边形,碳相邻的N、B两种元素可形成具有石墨型晶体结构,所以白石墨的最小结构单元的结构式为正六边形,且三个N原子三个B原子相互间隔分布在每个顶点上,据此画出“白石墨”的最小结构单元-六元环的结构式为:
 ,
,故答案为:
 .
.点评 本题考查了位置结构与性质关系的综合应用,题目难度中等,明确元素周期表结构、元素周期律内容与原子结构的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显蓝色的溶液中:NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、NO${\;}_{3}^{-}$ | |
| C. | c(H+):c(OH-)=1012的溶液中:Mg2+、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| D. | pH=0的溶液中:K+、Fe3+、SO${\;}_{4}^{2-}$、SCN- |
13.将过氧化钠投入FeCl2溶液中,可观察到的实验现象是( )
| A. | 有绿色气体产生 | B. | 没有沉淀生成 | ||
| C. | 有白色沉淀生成 | D. | 有红褐色沉淀生成 |
10.小明为研究添加食品中的食盐中的碘酸钾的稳定性,查阅文献得到相关信息如下,回答下列问题
(1)相同温度下,pH=0时,碘酸钾最不稳定.
(2)pH=7时,随着温度的升高碘酸钾的稳定性减弱.(填“增强”,“不变”或“减弱”);
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:取样,加淀粉溶液,如溶液变蓝说明有碘生成,反之,没碘生成.
| 编号 | 碘酸钾浓度/mol/L | pH | 碘酸钾损失率/% | |||
| 30℃ | 50℃ | 80℃ | 100℃ | |||
| 1 | 0.003 | 0 | 21 | 70.3 | 71 | 77.3 |
| 2 | 0.003 | 7 | 0 | 0.3 | 0.67 | 1 |
| 3 | 0.003 | 14 | 1.3 | 2.7 | 1.3 | 1 |
(2)pH=7时,随着温度的升高碘酸钾的稳定性减弱.(填“增强”,“不变”或“减弱”);
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:取样,加淀粉溶液,如溶液变蓝说明有碘生成,反之,没碘生成.
17.下列方程式书写正确的是( )
| A. | 苏打溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O | |
| C. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 表示乙醇燃烧热的热化学方程式(△H的绝对值正确):C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ•mol-1 |
 物质A是生产各种塑料的重要单体,工业上采用物质B分解制备物质A的同时释放出氢气,其制备原理是:
物质A是生产各种塑料的重要单体,工业上采用物质B分解制备物质A的同时释放出氢气,其制备原理是: