题目内容
14.碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题: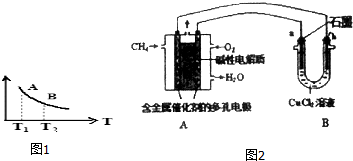
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ•molˉ1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则△H2=-1160kJ/mol;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁.其反应为:
Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)△H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g.则该段时间内CO的平均反应速率为0.012mol/(L•min).
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是bd
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
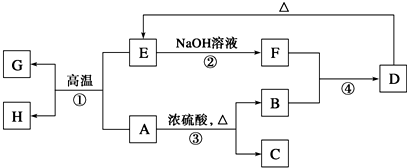
③该反应达到平衡时某物理量随温度变化如图1所示,当温度由T1升高到T2时,平衡常数KA<KB(填“>”、“<”或“=”).纵坐标可以表示的物理量有哪些bc.
a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)甲烷燃料电池可以提升能量利用率.如图2所示是利用甲烷燃料电池电解50ml2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是:CH4-8e-+10OH-=CO32-+7H2O.
②当A中消耗0.05mol氧气时,B中b极(填“a”或“b”)增重6.4g.
(4)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2$\stackrel{一定条件}{?}$2NH3,该过程中还原反应的方程式为N2+6H++6e-=2NH3.
分析 (1)根据盖斯定律书写二氧化氮转化为氮气的热化学方程式,从而计算反应热;
(2)①结合题干计算铁物质的量,根据化学方程式定量关系计算甲烷消耗的物质的量,依据化学反应速率概念计算得到;
②反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
③该反应是正反应气体体积增大的吸热反应,升温平衡正向移动,据此分析;
(3)①甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根生成水和碳酸根;
②b电极为阴极,阴极上铜离子放电生成Cu,根据Cu和转移电子之间的关系式计算;
(4)根据题目信息以及阴极得电子发生还原反应.
解答 解:(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2②
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,
将热化学方程式$\frac{①+②}{2}$得热化学反应方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=$\frac{-574+△{H}_{2}}{2}$kJ/mol=-867kJ/mol,△H2=-1160kJ/mol,
故答案为:-1160kJ/mol;
(2)①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g的物质的量=$\frac{3.2g}{106g/mol}$=0.02mol,结合化学方程式,Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g),计算反应的甲烷物质的量为0.06mol,则该段时间内CH4的平均反应速率=$\frac{\frac{0.06mol}{5L}}{1min}$=0.012mol/(L•min),
故答案为:0.012mol/(L•min);
②a.CH4的转化率与CO的产率与是否达到平衡状态无关,故a错误;
b.反应前后气体的物质的量和质量都不同,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,故b正确;
c、v(CO)与v(H2)的比值始终不变,所以其不能说明反应达到平衡状态,故c错误;
d、固体的总质量不变,说明正逆反应速率相等,反应达到平衡状态,故d正确;故答案为:bd;
③Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H>0,反应是气体体积增大的吸热反应,升温平衡正向移动,平衡常数增大,KA<KB;
a.H2的逆反应速率随温度的升高而增大,故a错误;
b.升温平衡正向移动,CH4的体积分数减小,故b正确;
c.升温平衡正向移动,混合气体的平均相对分子质量减小,故c正确;
d.升温平衡正向移动,CO的体积分数增大,故d错误;故答案为:<;bc;
(3)①甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根生成水和碳酸根,电极反应为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②A中消耗0.05mol氧气时,转移0.2mol电子,b电极为阴极,阴极上铜离子放电生成Cu,根据Cu和转移电子之间的关系式得析出Cu的质量=$\frac{0.2mol}{2}$×64g/mol=6.4g,故答案为:b;6.4;
(4)阴极得电子发生还原反应:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3.
点评 本题综合考查学生有关电化学、热化学、化学反应速率和平衡的有关计算等知识,综合性较强,难度大.

| A. | SO2在有的反应中显示氧化性,有的反应中显示还原性 | |
| B. | SO2是酸性氧化物,溶于水生成稳定的亚硫酸 | |
| C. | SO2气体通入Na0H溶液中一定得到Na2SO3 | |
| D. | SO2气体通入BaCl2溶液中,能生成白色沉淀 |
| 元素符号 | a | b | c | d | e | f | g | h |
| 原子半径/mm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合计 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
| 族/周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛.在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH).
①氢化铝锂易水解,最初得三种产物,请写出其水解反应方程式LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑.
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请写出这种还原剂的电子式.写出该物质受热分解的反应方程式:2NaBH4$\frac{\underline{\;\;△\;\;}}{\;}$2B+2NaH+3H2↑.
(4)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,写出“白石墨”的最小结构单元-六元环的结构式
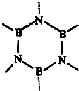 .
. | A. | S2-的结构示意图: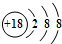 | |
| B. | CO2的比例模型: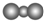 | |
| C. | 邻羟基苯甲酸的结构简式: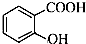 | |
| D. | 质子数为79、中子数为118的金(Au)原子:${\;}_{79}^{118}$Au |
| A. | 气体摩尔体积一定都约为22.4 L/mol | |
| B. | 通常状况(室温、101kP)下,气体摩尔体积约为22.4 L/mol | |
| C. | 标准状况(0℃、101kP)下,气体摩尔体积约为22.4 L/mol | |
| D. | 标准状况(0℃、101kP)下,1 mol H2O的体积是22.4 L |
| A. | 钠与水反应制氢气 | B. | 过氧化钠与水反应制氧气 | ||
| C. | 氯气与水反应制次氯酸 | D. | 氟单质与水反应制氧气 |
| A. | 1 mol Cl2完全反应转移的电子数一定是2NA | |
| B. | 标准状况下,22.4 L CCl4中含有的分子数为NA | |
| C. | 1 L 0.1 mol•L-1乙醇溶液中含有的氧原子数为0.1NA | |
| D. | 4 g氦气中含有的分子数和原子数均为NA |