题目内容
【题目】研究燃煤烟气的脱硫(除SO2)和脱硝(除NOx)具有重要意义,请回答下列问题。
(1)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。已知常温下,该溶液的pH=5,则![]() =_________(该温度下NH3· H2O的Kb=1.7×10-5)。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,
=_________(该温度下NH3· H2O的Kb=1.7×10-5)。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,![]() 的值将________(填“变大”、“不变”或“变小”)。
的值将________(填“变大”、“不变”或“变小”)。
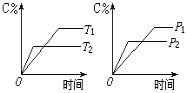
(2)用乙烯作为还原剂将氮的氧化物还原为N2的脱硝技术,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示。
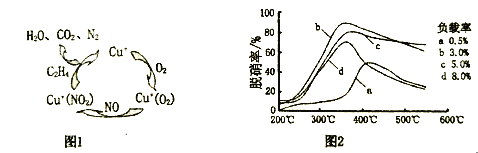
①写出该脱硝过程中乙烯和NO2反应的化学方程式:___________________。
②要达到最佳脱硝效果,应采取的条件是:___________________。
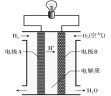
(3)利用如图装置可实现用Na2SO4溶液吸收SO2,再用离子膜电解法电解吸收液得到单质硫。
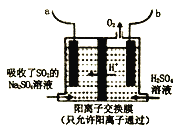
①a端应连接电源的_____(填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2使之转化为H2SO3,其目的是_______________。
③电解过程中,阴极的电极反应式为______________。
【答案】1.7×104 变大 2C2H4+6NO2=4CO2+3N2+4H2O 350℃(或340℃—360℃)、负载率3% 负极 提高溶液导电性,加快电解速率 SO2+4H++4e-=S+2H2O
【解析】
(1) pH=5,则c(OH-)=10-9mol/L,利用一水合氨的电离平衡常数计算![]() ;
;
(NH4)2SO4是强酸弱碱盐,在溶液中NH4+发生水解反应,根据浓度与盐水解反应关系判断![]() 的变化;
的变化;
(2)①在该脱硝过程中乙烯和NO2反应生成N2、CO2和水,根据电子守恒、原子守恒可得化学方程式:2C2H4+6NO2=4CO2+3N2+4H2O;
②脱硝率高,负载率低,适宜的温度;
(3)①根据H+移动方向判断电极的正负;
②用Na2SO4溶液吸收SO2气体,Na2SO4是电解质,可从增强溶液的导电性分析;
③电解过程中,阴极上SO2获得电子,发生还原反应,可根据示意图分析书写电极反应式。据此进行解答。
(1)pH=5,则c(H+)=10-5mol/L,根据Kw=10-14mol2/L2可得c(OH-)=10-9mol/L,NH3· H2O的Kb=![]() 1.7×10-5,则
1.7×10-5,则![]() =
=![]() =1.7×104;
=1.7×104;
(NH4)2SO4是强酸弱碱盐,在溶液中NH4+发生水解反应,NH4++H2O![]() NH3H2O+H+,使溶液显酸性,由于向该溶液中加入固体(NH4)2SO4时,c(NH4+)、c(SO42-)都增大,由于加入NH4+时,平衡正向移动,但平衡移动的趋势是微弱的,总的来说c(NH4+)占总浓度的比是增大,所以溶液
NH3H2O+H+,使溶液显酸性,由于向该溶液中加入固体(NH4)2SO4时,c(NH4+)、c(SO42-)都增大,由于加入NH4+时,平衡正向移动,但平衡移动的趋势是微弱的,总的来说c(NH4+)占总浓度的比是增大,所以溶液![]() 增大;
增大;
(2)①在该脱硝过程中乙烯和NO2反应生成N2、CO2和水,根据电子守恒、原子守恒可得化学方程式:
②要达到最佳脱硝效果,脱硝率高,负载率低,温度适宜,根据图示可知适合条件为350℃、负载率3%。
(3)①H+是阳离子,根据异种电荷相互吸引的原则可知左边电极为阴极,连接电源的负极;
②用电解方法吸收SO2气体,SO2被还原为S单质,Na2SO4是可溶性盐,是强电解质,在溶液中完全电离产生自由移动的离子,因此可增强溶液的导电性,从而可加快反应速率;
③中电解过程中,阴极上SO2获得电子,发生还原反应,该电极的反应式是SO2+4H++4e-=S+2H2O。