题目内容
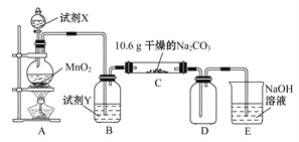
【题目】如何综合利用有毒的NO2气体一直是科研的热门话题,根据反应4NO2+O2=2N2O5,有些科学家设计了如图所示的燃料电池,下列相关说法正确的是

A.图示中Y为NO,可以循环利用
B.电池工作过程中,NO3-向石墨Ⅰ电极迁移
C.正极发生的反应为NO+O2+e- =NO3-
D.转移1 mol电子时,负极产物为0.5 mol
【答案】B
【解析】
根据反应4NO2+O2═2N2O5结合装置图可知,石墨I电极为原电池的负极,NO2被氧化,N元素化合价升高,应生成N2O5,电极方程式为NO2+NO3--e-═N2O5,石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,以此解答;
A. 石墨I电极为原电池的负极,NO2被氧化,N元素化合价升高,应生成N2O5,电极方程式为NO2+NO3--e-═N2O5,则图示中Y为N2O5,可以循环利用,A错误;
B. 石墨I为原电池的负极,所以电池工作过程中,NO3-向负极石墨Ⅰ电极迁移,B正确;
C. 石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,C错误;
D. 石墨I电极为原电池的负极,NO2被氧化,N元素化合价升高,应生成N2O5,电极方程式为NO2+NO3--e-═N2O5,则转移1mol电子时,负极产物为1mol,故D错误;
答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目