题目内容
18.如表是不同温度下水的离子积的数据:| 温度 | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”).
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)若在t2温度下测得某溶液pH=7,该溶液是碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性:则a:b=1:1.②若所得混合液pH=2,则a:b=9:11.
分析 (1)水是弱电解质,存在电离平衡,电离吸热;
(2)硫酸钠溶液是显中性的,加水稀释氢氧根离子浓度不变,钠离子浓度减小;
(3)t2温度下水的离子积常数是1×10-12,pH=6是显中性,根据酸碱混合溶液过量计算公式计算.
解答 解:(1))水是弱电解质,存在电离平衡,电离吸热.所以温度升高,水的电离程度增大,离子积增大,
故答案为:>;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1.
故答案为:1000:1;
(3)t2温度下水的离子积常数是1×10-12,所以在该温度下,pH=6是显中性的.因此某溶液pH=7,该溶液显碱性;
故答案为:碱;
①此温度下pH=11的NaOH溶液中OH-的浓度是0.1mol/L,若所得混合液为中性,由于硫酸中氢离子的浓度也是0.1mol/L,则a:b=1:1,
故答案为:1:1;
②所得混合溶液的pH=2,说明稀硫酸过量.所以有$\frac{0.1{V}_{2}-0.1{V}_{1}}{{V}_{1}+{V}_{2}}$=0.01,解得V1:V2=9:11,
故答案为:9:11.
点评 本题考查考查水的电离、水的离子积常数和pH的有关计算,题目难度中等,注意水的离子积常数与温度有关.

练习册系列答案
相关题目
8.下列有关实验操作及说法正确的是( )
| A. | 准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol•L-1的溶液 | |
| B. | 用硫粉覆盖地下撒有的汞;用热碱溶液洗去试管内壁的硫;用二氧化碳扑灭金属钠引起的失火;用湿润的红色石蕊试纸检验氨气是否集满;以上操作均合理 | |
| C. | 用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 | |
| D. | SO2溶于水,其水溶液能导电,说明SO2是电解质 |
9.在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2L此反应符合如图,下列叙述正确的是( )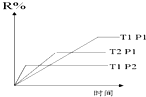

| A. | 正反应吸热,L是气体 | B. | 正反应吸热,L是固体 | ||
| C. | 正反应放热,L是气体 | D. | 正反应放热,L是固体 |
6.判断在下列装置中电流表中没有电流产生的是( )
| A. |  | B. | 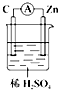 | C. | 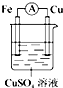 | D. | 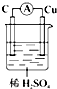 |
13.两种气态烃以任意比例混合,在120℃时将1L该混合烃跟9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中符合此实验结果的是( )
| A. | C2H4、C2H2 | B. | CH4、C2H6 | C. | CH4、C2H4 | D. | C2H2、C3H6 |
10.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合,c(Cl-)>c( NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
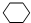 ,名称是环己烷.
,名称是环己烷.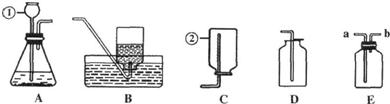
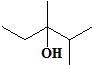
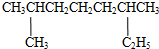 的系统命名是:2,6-二甲基辛烷
的系统命名是:2,6-二甲基辛烷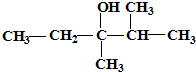 的键线式是
的键线式是