题目内容
将下列0.01mol/L的A组酸溶液各100mL与相对的同浓度同体积的B组碱溶液混合得溶液C.
C溶液pH值由大到小的顺序正确的是( )
| a | b | c | d | |
| [A组]酸 | 硫酸 | 盐酸 | 盐酸 | 盐酸 |
| [B组]碱 | 氢氧化钠 | 氢氧化钠 | 氢氧化钡 | 氨水 |
| A、b>c>d>a |
| B、c>b>d>a |
| C、b>c>a>d |
| D、c>b>a>d |
考点:pH的简单计算,水的电离
专题:电离平衡与溶液的pH专题
分析:a.硫酸与氢氧化钠的物质的量都是0.001 mol,发生反应后剩余0.0005molH2SO4,溶液呈酸性;
b.HCl与NaOH的物质的量都是0.001 mol,二者恰好反应,溶液呈中性;
c.HCl与氢氧化钡的物质的量都是0.001 mol,发生反应后剩余0.0005molBa(OH)2,溶液呈碱性;
d.HCl与氨气的物质的量都是0.001 mol,二者恰好反应得到NH4Cl溶液,铵根离子水解,溶液呈酸性,但酸性比a所得溶液酸性弱.
b.HCl与NaOH的物质的量都是0.001 mol,二者恰好反应,溶液呈中性;
c.HCl与氢氧化钡的物质的量都是0.001 mol,发生反应后剩余0.0005molBa(OH)2,溶液呈碱性;
d.HCl与氨气的物质的量都是0.001 mol,二者恰好反应得到NH4Cl溶液,铵根离子水解,溶液呈酸性,但酸性比a所得溶液酸性弱.
解答:
解:a.硫酸与氢氧化钠的物质的量都是0.001 mol,发生反应:H2SO4+2NaOH=Na2SO4+2H2O,剩余0.0005molH2SO4,溶液呈酸性;
b.HCl与NaOH的物质的量都是0.001 mol,发生反应:HCl+NaOH=NaCl+H2O,二者恰好反应,溶液呈中性;
c.HCl与氢氧化钡的物质的量都是0.001 mol,发生反应:2HCl+Ba(OH)2=BaCl2+2H2O,剩余0.0005molBa(OH)2,溶液呈碱性;
d.HCl与氨气的物质的量都是0.001 mol,发生反应HCl+NH3=NH4Cl,二者恰好反应,溶液中铵根离子水解,溶液呈酸性,酸性比a所得溶液酸性弱,
故溶液pH值由大到小的顺序是:c>b>d>a,
故选B.
b.HCl与NaOH的物质的量都是0.001 mol,发生反应:HCl+NaOH=NaCl+H2O,二者恰好反应,溶液呈中性;
c.HCl与氢氧化钡的物质的量都是0.001 mol,发生反应:2HCl+Ba(OH)2=BaCl2+2H2O,剩余0.0005molBa(OH)2,溶液呈碱性;
d.HCl与氨气的物质的量都是0.001 mol,发生反应HCl+NH3=NH4Cl,二者恰好反应,溶液中铵根离子水解,溶液呈酸性,酸性比a所得溶液酸性弱,
故溶液pH值由大到小的顺序是:c>b>d>a,
故选B.
点评:本题考查溶液pH判断与计算,难度不大,关键是根据方程式判断反应过量问题,注意d选项中盐类水解.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
电泳实验发现,硫化砷胶粒向阳极移动,下列措施不能使硫化砷胶体凝聚的是( )
| A、加入Al2(SO4)3溶液 |
| B、加入硅酸胶体 |
| C、加热 |
| D、加入Fe(OH)3胶体 |
活性炭可除水中氯气,反应为2Cl2+2H2O+C═4HCl+CO2,若水中Cl2浓度为4.0×10-6 mol/L,则每消耗96g活性炭,可处理上述水的体积是( )
| A、188.3 L |
| B、4.0×1010L |
| C、4.0×106L |
| D、8.0×106 L |
某温度时,测得0.01mol/L的NaOH溶液的PH为11,在此温度下,将pH=12的强碱与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比为( )
| A、1:9 | B、9:1 |
| C、1:11 | D、11:1 |
298K时,各反应的平衡常数如下:
①N2(g)+O2(g)?2NO(g) K=1×10-30;
②2H2(g)+O2(g)?2H2O(g) K=2×1081
③2CO2(g)?2CO(g)+O2(g) K=4×10-92
则常温下,NO、H2O、CO2这三种化合物分解放氧的倾向最大的是( )
①N2(g)+O2(g)?2NO(g) K=1×10-30;
②2H2(g)+O2(g)?2H2O(g) K=2×1081
③2CO2(g)?2CO(g)+O2(g) K=4×10-92
则常温下,NO、H2O、CO2这三种化合物分解放氧的倾向最大的是( )
| A、① | B、② | C、③ | D、无法判断 |
下列说法错误的是( )
| A、SO2通入BaCl2溶液中无沉淀产生,通入FeCl3和BaCl2的混合溶液中有白色沉淀生成 |
| B、红磷在氯气中燃烧产生白色烟雾 |
| C、氯化碘(ICl)的化学性质与氯气相似,它跟水反应可生成HI和HClO |
| D、可在NaOH溶液液面上用倒扣漏斗装置吸收残余氯气 |
关于下列各装置图的叙述不正确的是( )
A、 用装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
B、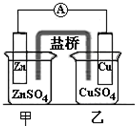 装置的盐桥中KCl的Cl-移向甲烧杯 |
C、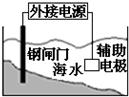 装置中钢闸门应与外接电源的正极相连获得保护 |
D、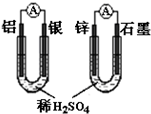 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |
下列说法正确的是( )
| A、煤经处理变为气体燃料的过程属于物理变化 |
| B、淀粉、油脂和蛋白质都是高分子化合物 |
| C、乙烯和乙醇均可使酸性KMnO4溶液褪色 |
| D、乙酸乙酯和植物油均可水解生成乙醇 |
钠多以资源丰富的NaCl为原料来制备,下列方法中能够制备出金属钠的是( )
| A、加热NaCl晶体 |
| B、用金属钾置换出NaCl溶液中Na+ |
| C、电解NaCl溶液 |
| D、电解熔融的NaCl |