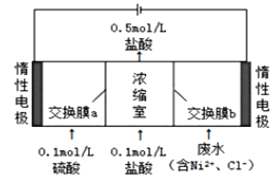
题目内容
【题目】现有A、B、C、D 4种元素,前3种元素的离子都和氖原子具有相同的核外电子排布。A元素没有正化合价;B的氢化物分子式为H2B。0.2 mol的C单质能从酸中置换出2.24 L H2(标准状况)。D的原子核中没有中子。
(1)根据以上条件,判断A、B、C、D的元素名称:
A________,B________,C________,D________。
(2)用电子式表示C与A、C与B、B与D相互结合成的化合物,指出其化合物的类型及化学键类型:
①C+A2:电子式____________,化合物类型__________,化学键类型____________;
②C+B2:电子式____________,化合物类型__________,化学键类型____________;
③B+D2:电子式____________,化合物类型__________,化学键类型____________;
【答案】氟 氧 钠 氢 ![]() 离子化合物 离子键
离子化合物 离子键 ![]() (或
(或![]() ) 离子化合物 离子键(或离子键、非极性共价键)
) 离子化合物 离子键(或离子键、非极性共价键) ![]() (或
(或![]() ) 共价化合物 极性共价键(或极性共价键、非极性共价键)
) 共价化合物 极性共价键(或极性共价键、非极性共价键)
【解析】
A、B、C三种元素的离子结构都和氖原子具有相同的核外电子排布,A没有正价态的化合物,B的氢化物化学式为H2B,则A为F、B为O;0.2molC单质能从酸中置换产生2.24LH2(标准状况),C为金属,氢气是0.1mol,则其化合价为+1价,C为Na,D的原子核内没有中子,则D元素为氢;据此解答。
(1)根据上述分析可知,四种元素分别为:氟、氧、钠、氢;
(2)①C元素为钠,A元素为氟,二者形成的化合物为氟化钠,电子式为:![]() ;在氟化钠中含有离子键,其属于离子化合物
;在氟化钠中含有离子键,其属于离子化合物
②C元素为钠,B元素为氧,二者形成的化合物为氧化钠,钠失电子,氧得电子,形成离子化合物,电子式为:![]() ,该物质中含有离子键;钠在氧气中燃烧能生成过氧化钠,电子式为:
,该物质中含有离子键;钠在氧气中燃烧能生成过氧化钠,电子式为:![]() ,该物质中含有离子键和非极性共价键;
,该物质中含有离子键和非极性共价键;
③B元素为氧,D元素为氢,二者形成的化合物为水,水的电子式为:![]() ,氢和氧形成共用电子对,分子中只含有极性共价键,为共价化合物;氢与氧还能形成过氧化氢,过氧化氢的电子式为:
,氢和氧形成共用电子对,分子中只含有极性共价键,为共价化合物;氢与氧还能形成过氧化氢,过氧化氢的电子式为:![]() ,其中含有极性共价键和非极性共价键,为共价化合物。
,其中含有极性共价键和非极性共价键,为共价化合物。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:

(1)根据实验数据可知,该反应在0~4min的平均反应速率v(Cl-)=______mol/(L·min)。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
i.探究化学反应速率增大的影响因素:
已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+
方案 | 假设 | 具体实验操作 |
Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中依次加入10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,______。 |
Ⅱ | 反应产物Cl-对反应有催化作用 | 取10mL 0.1mol/L KClO3溶液于烧杯中,先加入_____固体(填化学式),再加入10mL 0.3mol/L NaHSO3溶液。 |
Ⅲ | 反应中溶液酸性增强,加快了化 学反应速率 | 分别向2个烧杯中加入10mL 0.1mol/L KClO3溶液, 烧杯①:加入1mL水烧杯②:加入1mL 0.2mol/L盐酸再分别向烧杯中加入10mL 0.3mol/L NaHSO3溶液。 |
(问题与思考)
①方案Ⅲ烧杯①中加入1mL水的作用是______。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案III实验操作设计不严谨,改进措施为______。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设_______。
ii.反应后期,化学反应速率降低的主要原因是______。