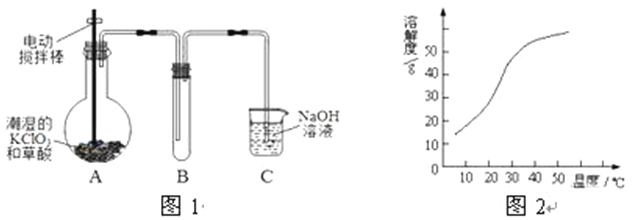
题目内容
【题目】100mL 0.1mol/L盐酸与50mL 0.2mol/L 氨水混合,在所得溶液中( )
A. c(Cl-)>c(NH4+)> c(OH-)> c(H+) B. c(Cl-)=c(NH4+)> c(OH-)= c(H+)
C. c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3.H2O) D. c(H+)+ c(NH4+)=c(Cl-)
【答案】C
【解析】A、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O![]() NH3·H2O+H+,溶液显酸性,则c(Cl-)>c(NH4+)> c(H+)> c(OH-),故A错误;B、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O
NH3·H2O+H+,溶液显酸性,则c(Cl-)>c(NH4+)> c(H+)> c(OH-),故A错误;B、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O![]() NH3·H2O+H+,则c(Cl-)>c(NH4+),故B错误;C、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O
NH3·H2O+H+,则c(Cl-)>c(NH4+),故B错误;C、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O![]() NH3·H2O+H+,根据电荷守恒,c(H+)+c(NH4+)= c(OH-)+c(Cl-),根据物料守恒,c(Cl-)= c(NH4+)+c(NH3·H2O),变形为2c(Cl-)=2 c(NH4+)+2c(NH3·H2O),则c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3·H2O),故C正确;D、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O
NH3·H2O+H+,根据电荷守恒,c(H+)+c(NH4+)= c(OH-)+c(Cl-),根据物料守恒,c(Cl-)= c(NH4+)+c(NH3·H2O),变形为2c(Cl-)=2 c(NH4+)+2c(NH3·H2O),则c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3·H2O),故C正确;D、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O![]() NH3·H2O+H+,根据电荷守恒,c(H+)+c(NH4+)= c(OH-)+c(Cl-),则c(H+)+ c(NH4+)>c(Cl-),故D错误;故选C。
NH3·H2O+H+,根据电荷守恒,c(H+)+c(NH4+)= c(OH-)+c(Cl-),则c(H+)+ c(NH4+)>c(Cl-),故D错误;故选C。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】下列除杂方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
A | FeCl3(aq) | Fe2+ | 新制氯水 |
B | FeCl2(aq) | Fe3+ | Cu粉 |
C | NaHCO3(aq) | Na2CO3 | CO2气体 |
D | Mg粉 | Al粉 | NaOH(aq)、过滤 |
A. A B. B C. C D. D