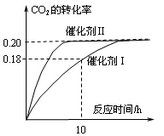
题目内容
已知CO2可以生产绿色燃料甲醇。CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2)
=" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g)
ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2)
=" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
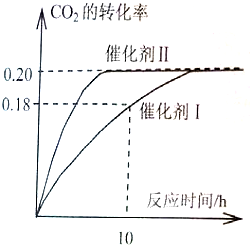
(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)= ______mol.(L.h)-1。
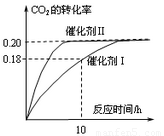
(2)下列叙述正确的是______。(双选)
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂II比催化剂I高
D.催化效率:在上述反应条件下,催化剂II比催化剂I高
(3)根椐图中数据,计算此反应在3000C时的平衡常数。(写出计箅过程)
(4)将上述平衡体系升温至400°C, 平衡常数:K(4000C) ______ K(3000C) (填<、=或> )。
(5)其它条件不变,若上述反应在催化剂Ⅱ,400°C下达到平衡,请在上图画出CO2转化率随时间变化图。
(16分)(1) 0.054 (3分)(2) A D (4分)
(3) K="0.050" (L/mol)2 (4分) (4)
< (2分)
(5)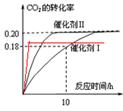 (3分)
(3分)
【解析】
试题分析:(1)根据图像可知,使用催化剂 I时,反应在10小时时CO2的转化率是0.18,则消耗CO2的物质的量浓度是0.18×1.00mol/L=0.18mol/L,则根据方程式可知,消耗氢气的物质的量是0.18mol/L×3=0.54mol/L,所以氢气的反应速率是0.54mol/L÷10h=0.054mol/(L·h)。
(2) 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变的,则A正确;充入氩气増大压强,但物质的浓度不变,平衡不移动,则CO2的转化率不变,B不正确;催化剂只能改变反应速率,不能改变平衡状态,则转化率是不变的,C不正确;根据图像可知,在催化剂Ⅱ时反应速率快,达到平衡的时间少,催化效率高,D正确,答案选AD。
(3) CO2(g)
+ 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
起始浓度(mol/L) 1.00 1.60 0 0
转化浓度(mol/L) 0.20 0.60 0.20 0.20
平衡浓度(mol/L) 0.80 1.00 0.20 0.20
所以平衡常数K=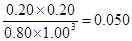
(4)该反应是放热反应,则升高温度平衡向逆反应方向移动,平衡常数减小,则平衡常数:K(4000C)<K(3000C)。
(5)升高温度,反应速率加快,达到平衡的时间减少,但CO2的转化率降低,所以图像是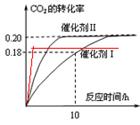
考点:考查反应速率、平衡常数的计算、外界条件对平衡状态的影响和平衡状态的判断以及图像识别
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范答题能力,有助于提升学生的学科素养。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
 已知CO2可以生产绿色燃料甲醇.
已知CO2可以生产绿色燃料甲醇.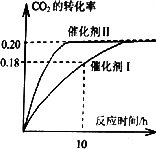
 CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题: