��Ŀ����
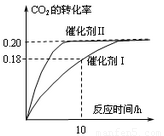
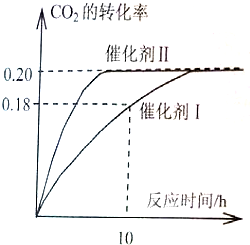 ��֪CO2����������ɫȼ�ϼ״���
��֪CO2����������ɫȼ�ϼ״���CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-187.4kJ?mol-1��300��ʱ���ܱ������У�
��c��CO2��=1.00mol?L-1��c��H2��=1.60mol?L-1��ʼ��Ӧ���������ͼ��ʾ���ش��������⣺
��1��ʹ�ô���Iʱ����Ӧ��10Сʱ�ڵ�ƽ����Ӧ���ʣ�
v��H2��=
��2������������ȷ����
A����������������ܶȲ��ٸı�ʱ����Ӧ��һ���ﵽƽ��״̬
B�������������ѹǿ���������CO2��ת����
C��CO2ƽ��ת���ʣ���������Ӧ�����£�������ȴ������
D����Ч�ʣ���������Ӧ�����£�������ȴ������
��3�����ͼ�����ݣ�����˷�Ӧ��300��ʱ��ƽ�ⳣ����
��4��������ƽ����ϵ������400�棬ƽ�ⳣ��K��400�棩
��5����֪��2H2��g��+O2��g��=2H2O��g����H=-242.8kJ?mol-1
��Ӧ2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��g������H=
��������1�����ݷ�Ӧ��10Сʱ�ڶ�����̼��ת���ʼ�������Ķ�����̼�����ʵ���Ũ�ȣ��ټ�����ö�����̼��ʾ��ƽ����Ӧ���ʣ������ݷ�Ӧ�����뻯ѧ�������Ĺ�ϵ�������������ʾ�ķ�Ӧ���ʣ�
��2��A���÷�Ӧ���߶������壬�����ݻ����䣬�����ܶ�ʼ�ղ��䣻
B������ϡ�����壬��Ӱ�췴Ӧ��ϵ�и����Ũ�ȣ���ѧƽ�ⲻ�ƶ���
C������ֻӰ�췴Ӧ���ʣ���Ӱ�컯ѧƽ�⣻
D������ͼʾ��֪���ڴ����������µķ�Ӧ���ʴ��ڱȴ����������µķ�Ӧ���ʣ�
��3������ͼ���дﵽƽ��״̬ʱ������̼��ת���ʡ����û�ѧƽ������ʽ������ﵽƽ��״̬ʱ����ֵ�Ũ�ȣ�Ȼ������ƽ�ⳣ������ʽ��������¶��µ�ƽ�ⳣ����
��4���÷�ӦΪ���ȷ�Ӧ���¶����ߣ���ѧƽ�����������ƶ�����ѧƽ�ⳣ����С��
��5�����������Ȼ�ѧ����ʽ����˹���ɼ������Ӧ2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��g�����ʱ䣮
��2��A���÷�Ӧ���߶������壬�����ݻ����䣬�����ܶ�ʼ�ղ��䣻
B������ϡ�����壬��Ӱ�췴Ӧ��ϵ�и����Ũ�ȣ���ѧƽ�ⲻ�ƶ���
C������ֻӰ�췴Ӧ���ʣ���Ӱ�컯ѧƽ�⣻
D������ͼʾ��֪���ڴ����������µķ�Ӧ���ʴ��ڱȴ����������µķ�Ӧ���ʣ�
��3������ͼ���дﵽƽ��״̬ʱ������̼��ת���ʡ����û�ѧƽ������ʽ������ﵽƽ��״̬ʱ����ֵ�Ũ�ȣ�Ȼ������ƽ�ⳣ������ʽ��������¶��µ�ƽ�ⳣ����
��4���÷�ӦΪ���ȷ�Ӧ���¶����ߣ���ѧƽ�����������ƶ�����ѧƽ�ⳣ����С��
��5�����������Ȼ�ѧ����ʽ����˹���ɼ������Ӧ2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��g�����ʱ䣮
����⣺��1���ô���Iʱ����Ӧ��10Сʱ�ڶ�����̼��ת����Ϊ0.18��������̼��Ũ�ȱ仯Ϊ��1.00mol?L-1��0.18=0.18mol/L����Ӧ��10Сʱ�ڶ�����̼��ƽ����Ӧ����Ϊ��v��CO2��=
=0.018mol?��L?h��-1����v��H2��=3v��CO2��=0.054mol?��L?h��-1��
�ʴ�Ϊ��0.054��
��2��A���÷�Ӧǰ��������������䣬�������ݻ��̶������Ի��������ܶ�ʼ�ղ��䣬�ʵ�������������ܶȲ��ٸı�ʱ����Ӧ��һ���ﵽƽ��״̬����A��ȷ��
B�������������ѹǿ�����Ƿ�Ӧ��ϵ�и���ֵ�Ũ�Ȳ��䣬��ѧƽ�ⲻ�����ƶ�������CO2��ת���ʲ��䣬��B����
C��������Ӱ�컯ѧƽ�⣬����CO2ƽ��ת������������Ӧ�����£���������������ת������ȣ���C����
D����������Ӧ�����£�������ķ�Ӧ���ʴ��ڴ�����ģ�˵��������ȴ�����Ĵ�Ч�ʸߣ���D��ȷ��
��ѡAD��
��3��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L��1.00 1.60 0 0
�仯Ũ�ȣ�mol/L��0.20 0.60 0.20 0.20
ƽ��Ũ�ȣ�mol/L��0.80 1.0 0.20 0.20
K=
=
=0.050L2?mol-2��
�ʴ�Ϊ��0.050 L2?mol-2��
��4�����ڸ÷�ӦΪ���ȷ�Ӧ���¶�����ѧƽ�����������ƶ�����Ӧ��Ũ�ȼ�С��������Ũ������ѧƽ�ⳣ������ƽ�ⳣ��K��400�棩��K��300�棩��
�ʴ�Ϊ������
��5��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-187.4kJ?mol-1��
2H2��g��+O2��g��=2H2O��g����H=-242.8kJ?mol-1��
�ɸ�˹���ɣ��ڡ�3-�١�2�ɵã�2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��g������H=��-242.8kJ?mol-1����3-��-187.4kJ?mol-1����2=-353.6kJ?mol-1
�ʴ�Ϊ��-353.6��
| 0.18mol/L |
| 10h |
�ʴ�Ϊ��0.054��
��2��A���÷�Ӧǰ��������������䣬�������ݻ��̶������Ի��������ܶ�ʼ�ղ��䣬�ʵ�������������ܶȲ��ٸı�ʱ����Ӧ��һ���ﵽƽ��״̬����A��ȷ��
B�������������ѹǿ�����Ƿ�Ӧ��ϵ�и���ֵ�Ũ�Ȳ��䣬��ѧƽ�ⲻ�����ƶ�������CO2��ת���ʲ��䣬��B����
C��������Ӱ�컯ѧƽ�⣬����CO2ƽ��ת������������Ӧ�����£���������������ת������ȣ���C����
D����������Ӧ�����£�������ķ�Ӧ���ʴ��ڴ�����ģ�˵��������ȴ�����Ĵ�Ч�ʸߣ���D��ȷ��
��ѡAD��
��3��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L��1.00 1.60 0 0
�仯Ũ�ȣ�mol/L��0.20 0.60 0.20 0.20
ƽ��Ũ�ȣ�mol/L��0.80 1.0 0.20 0.20
K=
| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |
| 0.20mol/L��0.20mol/L |
| 0.80mol/L��(1.0mol/L)3 |
�ʴ�Ϊ��0.050 L2?mol-2��
��4�����ڸ÷�ӦΪ���ȷ�Ӧ���¶�����ѧƽ�����������ƶ�����Ӧ��Ũ�ȼ�С��������Ũ������ѧƽ�ⳣ������ƽ�ⳣ��K��400�棩��K��300�棩��
�ʴ�Ϊ������
��5��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-187.4kJ?mol-1��
2H2��g��+O2��g��=2H2O��g����H=-242.8kJ?mol-1��
�ɸ�˹���ɣ��ڡ�3-�١�2�ɵã�2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��g������H=��-242.8kJ?mol-1����3-��-187.4kJ?mol-1����2=-353.6kJ?mol-1
�ʴ�Ϊ��-353.6��
���������⿼���˻�ѧ��Ӧ���ʡ���ѧƽ�ⳣ���ļ��㡢Ӱ�컯ѧ��Ӧ�������ء��Ȼ�ѧ����ʽ��д����˹���ɵ�Ӧ�õ�֪ʶ����Ŀ�Ѷ��еȣ�ע�����ջ�ѧ��Ӧ���ʡ���ѧƽ�ⳣ���ı���ʽ�����㷽������ȷ��˹���ɵĺ��弰��Ӧ�÷�����

��ϰ��ϵ�д�
�����Ŀ
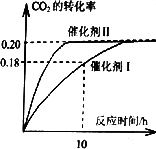
 CH3OH(g) + H2O(g) ��H����187.4 kJ/mol��3000Cʱ�ĺ����ܱ������У���C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1��ʼ��Ӧ���������ͼ��ʾ���ش��������⣺
CH3OH(g) + H2O(g) ��H����187.4 kJ/mol��3000Cʱ�ĺ����ܱ������У���C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1��ʼ��Ӧ���������ͼ��ʾ���ش��������⣺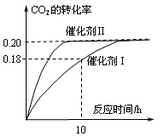
 CH3OH(g) + H2O(g)
��H����187.4 kJ/mol��3000Cʱ�ĺ����ܱ������У���C(CO2) = 1.00 mol.L-1 C(H2)
=" 1.60" mol.L-1��ʼ��Ӧ���������ͼ��ʾ���ش��������⣺
CH3OH(g) + H2O(g)
��H����187.4 kJ/mol��3000Cʱ�ĺ����ܱ������У���C(CO2) = 1.00 mol.L-1 C(H2)
=" 1.60" mol.L-1��ʼ��Ӧ���������ͼ��ʾ���ش��������⣺