题目内容
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式:_____________。
(2)在海洋循环中,通过如图所示的途径固碳。
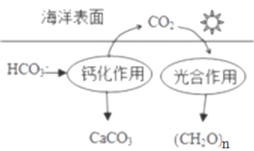
①写出钙化作用的离子方程式:_____________。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:_____________+_____________=(CH2O)x+x18O2+xH2O,_____________
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图所示),将虚线框中的装置补充完整并标出所用试剂。_____________

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymLHCl溶液,海水中溶解无机碳的浓度=_____________mol/L。
【答案】CO2+H2O![]() H2CO3,H2CO3
H2CO3,H2CO3![]() HCO3-+H+ Ca2++2HCO3-=CaCO3↓+CO2↑+H2O xCO2 2xH218O
HCO3-+H+ Ca2++2HCO3-=CaCO3↓+CO2↑+H2O xCO2 2xH218O 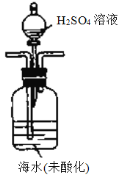
![]()
【解析】
(1)CO2溶于水生成碳酸,碳酸是弱电解质,在水中部分发生电离;
(2)①由图可知,钙化作用过程是碳酸氢根离子转化生成碳酸钙,据此书写离子方程式;
②光合作用是CO2与水在太阳光作用下,在叶绿体中反应生成有机物、放出氧气的过程,氧气来源于水中的氧;
(3)①需从酸化后的海水中吹出二氧化碳,那么就需要滴加稀酸酸化,且装置应从长管进氮气,从短导管吹出二氧化碳;
②依据原理NaHCO3+HCl=NaCl+CO2↑+H2O 。
(1)溶于海水的CO2与水结合生成碳酸,碳酸电离生成碳酸氢根离子HCO3-,故CO2溶于水产生HCO3-的方程式:CO2+H2O![]() H2CO3,H2CO3
H2CO3,H2CO3![]() HCO3-+H+ ;
HCO3-+H+ ;
(2)①反应物中含有碳酸氢根离子,生成物为碳酸钙,依据元素守恒、电荷守恒得出离子方程式为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O;
②光合作用产生的氧气来源于水,即水中的氧原子采用示踪法标记为18O,依据元素守恒配平方程式, xCO2+2xH218O=(CH2O)x+x18O2+xH2O ;
(3)①酸化海水,可以使用试剂:稀硫酸、利用分液漏斗滴加,长管进气,短管出气,故装置为 ;
;
②滴定过程中发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,故n(NaHCO3)=n(HCl)=xmol/L×y×10-3L,根据C守恒,海水中溶解无机碳的浓度=![]() =
=![]() mol
mol![]() L-1。
L-1。

【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ |
(1)⑤元素的原子结构示意图为_____________;
(2)③元素原子的最外层电子数为___________;
(3)⑤元素与④元素形成的离子化合物的化学式为_________(写出一种即可);
(4)②、③、④三种元素的非金属性逐渐___________(填“减弱”或“增强”);
(5)④元素和⑥元素形成的氢化物,其稳定性的强弱顺序为_______>_______(填化学式)。
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。