题目内容
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
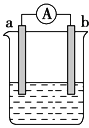
(1)当电极a为Al,电极b为Mg,电解质溶液为稀硫酸时,该电池的正极为________ (填元素符号),负极的电极反应式为:__________________。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的正极为____(填元素符号),负极的电极反应式为:__________________ 。
(3)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
①该蓄电池放电时,电解质溶液中阴离子移向_____(填“正极”或“负极”);正极附近溶液的酸性_________(填“增强”、“减弱”或“不变”)放电时,负极的电极反应式为:__________________(用离子方程式表示)。
②实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得0.050 mol Cl2,这时电池内消耗的H2SO4的物质的量至少是____________。氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为______________。该电池工作时,外电路每流过1 mol e-,消耗标况下氧气_________L。
【答案】 Al Mg-2 e-==Mg2+ Mg Al+ 4OH- -3 e- == AlO2- +2H2O 负极 减弱 Pb - 2e- +SO42-=PbSO4 0.10 mol H2 - 2e- +2OH-= 2H2O(或 2H2 - 4e- +4OH-= 4H2O) 5.6
【解析】(1)Al、Mg、硫酸溶液可构成原电池,镁比铝活泼,镁为负极,铝为正极,负极上镁失去电子,正极上水中的氢离子得到电子,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为: Al;Mg-2 e-==Mg2+;
(2)Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,正极上水得到电子生成氢气和氢氧根离子,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为: Mg;Al+ 4OH- -3 e- == AlO2- +2H2O;
(3)①该蓄电池放电时是原电池,在原电池中,电解质溶液中阴离子移向负极;该电池工作时,铅蓄电池正极为PbO2,PbO2得电子发生还原反应,电极反应为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,正极附近溶液的酸性减弱;放电时,负极铅失电子发生氧化反应,负极的电极反应式为Pb - 2e- +SO42-=PbSO4,故答案为:负极;减弱;Pb - 2e- +SO42-=PbSO4;
②根据电子转移守恒,结合负极:Pb+SO42-=PbSO4+2e-,可知生成0.05mol氯气时,转移电子0.1mol,参加反应Pb的物质的量![]() =0.05mol,由正极、负极电极反应式可知,电池总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,故消耗硫酸至少为0.05mol×2=0.1mol;燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,负极上氢气失电子生成水,则负极的电极方程式为2H2+4OH--4e-=4H2O;该电池中正极上是氧气发生得电子的还原反应,其电极反应为:O2+2H2O+4e-=4OH-,则外电路每流过1mol e-,消耗氧气为
=0.05mol,由正极、负极电极反应式可知,电池总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,故消耗硫酸至少为0.05mol×2=0.1mol;燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,负极上氢气失电子生成水,则负极的电极方程式为2H2+4OH--4e-=4H2O;该电池中正极上是氧气发生得电子的还原反应,其电极反应为:O2+2H2O+4e-=4OH-,则外电路每流过1mol e-,消耗氧气为![]() mol,所以氧气的体积为
mol,所以氧气的体积为![]() mol×22.4L/mol=5.6L,故答案为:H2 - 2e- +2OH-= 2H2O(或 2H2 - 4e- +4OH-= 4H2O);5.6。
mol×22.4L/mol=5.6L,故答案为:H2 - 2e- +2OH-= 2H2O(或 2H2 - 4e- +4OH-= 4H2O);5.6。

【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
相关数据如下:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡过程体系的能量变化 | |||
CO | H2O | CO2 | H2O | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等