题目内容
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
相关数据如下:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡过程体系的能量变化 | |||
CO | H2O | CO2 | H2O | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等
【答案】D
【解析】A.平衡时放出的热量为32.8 kJ,故参加反应的CO的物质的量![]() CO的转化率为
CO的转化率为![]() ,故A正确;B、容器①②温度相同,平衡常数相同,根据容器①计算平衡常数,由A计算可知,平衡时CO的物质的量变化量为0.8mol,
,故A正确;B、容器①②温度相同,平衡常数相同,根据容器①计算平衡常数,由A计算可知,平衡时CO的物质的量变化量为0.8mol,
则:CO(g)+H2O(g)CO2(g)+H2(g)
开始(mol):1 4 00
变化(mol):0.8 0.8 0.8 0.8
平衡(mol):0.2 3.2 0.8 0.8
故平衡常数K=![]() =1
=1
故容器②中的平衡常数为1,令容器②中CO2的物质的量变化量为amol,则:
CO2(g)+H2(g)CO(g)+H2O(g)
开始(mol):1 4 00
变化(mol):a a a a
平衡(mol):1-a4-aa a
所以![]() ,解得a=0.8。
,解得a=0.8。
计算可知CO2的转化率为![]() ,故B正确;
,故B正确;
C、速率之比等于化学计量数之比,故容器①中CO反应速率等于H2O的反应速率,故C正确;D、结合B选项的计算,由A中计算可知容器①平衡时CO2的物质的量为0.8mol,容器②中CO2的物质的量为1mol-0.8mol=0.2mol,容器的体积相同,平衡时,两容器中CO2的浓度不相等,故D错误;故选D。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】一定条件下,CO2与NH3反应可制得重要的化工产品三聚氰胺:3NH3 + 3CO2![]()
 +3H2O。
+3H2O。
(1)基态N原子的价层电子排布图为____________,三聚氰胺的几种组成元素中电负性由大到小的顺序为____________(用元素符号表示)。
(2)三聚氰胺中氮原子的杂化轨道类型为____________。
(3)上述合成三聚氰胺的反应过程中存在多种类型化学键的断裂与形成,但这些化学键中不包括____________(填选项字母)。
a.α键 b.π键 c.非极性共价键 d.极性共价键
(4)三聚氰胺的熔点为250 ℃,则其晶体类型是____________,又知硝基苯的熔点为5.7 ℃,异致这两种物质熔点差异的原因是____________。
(5)随者科学技术的发展,科学家们已合成了由碳、氧两种元素形成的原子晶体.其晶胞结构如图(a) 所示:若晶胞参数为a pm,设NA表示阿伏加德罗常数的值,则该晶胞的密度是____________ g cm-3。
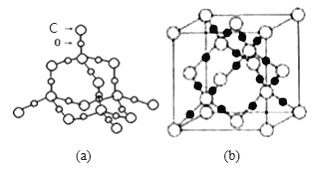
(6)SiO2晶体结构片断如图 (b)所示。通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。
化学键 | Si-O | Si-Si | O=O |
键能/ KJ·mol-1 | 460 | 176 | 498 |
Si(s)+O2(g)![]() SiO2(s),该反应的反应热△H = ___________
SiO2(s),该反应的反应热△H = ___________