题目内容
【题目】25℃,将0.4mol/L CH3COOH 溶液和 0.2mol/L NaOH 溶液各 100mL 混合后,pH=5,(设混合后溶液总体积为两溶液体积之和)
(1)混合溶液中离子浓度由大到小的顺序是
(2)①c(CH3COO﹣)+c(CH3COOH)= mol/L②c(CH3COO﹣)﹣c(CH3COOH)= mol/L.
【答案】c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣);0.2;2×(10﹣5﹣10﹣9 )
【解析】(1)0.4mol/L CH3COOH溶液和 0.2mol/LNaOH溶液各100mL混合后,生成等浓度的醋酸钠和醋酸溶液,溶液的pH=5,则溶液显示酸性,c(H+)>c(OH﹣),根据电荷守恒c(H+)+c(Na+)=c(CH3COO﹣)+c(OH﹣)可得:c(CH3COO﹣)>c(Na+),则溶液中各离子浓度大小为:c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣),
所以答案是:c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣);
(2)①根据物料守恒恒可得:2c(Na+)=c(CH3COO﹣)+c(CH3COOH)=0.4mol/L×![]() =0.2mol/L,
=0.2mol/L,
所以答案是:0.2;
②溶液的pH=5,则溶液中氢离子浓度为:c(H+)=10﹣5mol/L,氢氧根离子浓度为:c(OH﹣)=10﹣9mol/L,
根据电荷守恒可得:①c(H+)+c(Na+)=c(CH3COO﹣)+c(OH﹣),根据物料守恒可得:②2c(Na+)=c(CH3COO﹣)+c(CH3COOH),将②带入①×2可得:c(CH3COO﹣)﹣c(CH3COOH)=2c(H+)﹣2c(OH﹣)=2×(10﹣5﹣10﹣9 )mol/L,
所以答案是:2×(10﹣5﹣10﹣9 ).

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7 Ka2=4.7×10﹣11 |
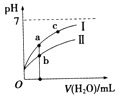
A.如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a