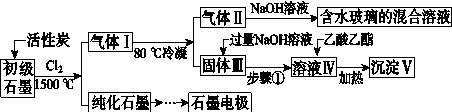
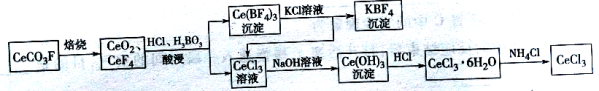
题目内容
【题目】某同学探究某有机物A的结构,进行如下实验:
①取6.0克A在氧气中完全燃烧,将生成气体依次通过M(装有浓硫酸)和N(装有碱石灰)洗气瓶,M增重7.2克,N增重13.2克。
②测定相对分子质量为60。
③测定核磁共振氢谱,有三个强峰,比值为6:1:1
据此回答下列问题:
(1)②中测定相对分子质量的方法为 ;
(2)写出A的分子式 ;
(3)A发生消去反应的化学方程式 ;
(4)A与乙酸反应的化学方程式 。
【答案】(1)质谱法 (2)C3H8O (3) CH3CH(OH)CH3![]() CH3CH=CH2↑+H2O
CH3CH=CH2↑+H2O
(4)CH3COOH+HO-CH(CH3)2 ![]() CH3COOCH(CH3)2+H2O
CH3COOCH(CH3)2+H2O
【解析】
试题分析:(1)通过质谱法可以测定出有机物的相对分子质量;
(2)6.0g该有机物的物质的量为:6.0g÷60g/mol=0.1mol,7.2g水的物质的量为:7.2g÷18g/mol
=0.4mol,含有H原子的物质的量为0.8mol,质量为:1g/mol×0.8mol=0.8g,13.2g二氧化碳的物质的量为:13.2g÷44g/mol=0.3mol,12g/mol×0.3mol=3.6g,3.6g+0.8g=4.4g<6.0g,则该有机物中一定含有氧元素,其物质的量为:(6.0g4.4g)÷16g/mol=0.1mol,则该有机物分子中含有C、H、O原子的数目为:N(C)=0.3mol÷0.1mol=3、N(H)=0.8mol÷0.1mol=8、N(O)=0.1mol÷0.1mol=1,故该有机物分子式为:C3H8O;
(3)测定核磁共振氢谱,有三个强峰,比值为6:1:1,说明其分子中含有2个甲基,则该有机物的结构简式为:CH3CH(OH)CH3,其发生消去反应的化学方程式为:CH3CH(OH)CH3![]() CH3CH=CH2↑+H2O;
CH3CH=CH2↑+H2O;
(4)A分子中含有羟基,能够发生酯化反应,则A与乙酸反应的化学方程式为CH3COOH+HO-CH(CH3)2 ![]() CH3COOCH(CH3)2+H2O。
CH3COOCH(CH3)2+H2O。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案