题目内容
【题目】【2016届怀化一模】燃料的使用和防污染是社会发展中一个无法回避的矛盾话题。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-860.0 kJ·mol-1
②2NO2(g)![]() N2O4(g) ΔH2=-66.9 kJ·mol-1
N2O4(g) ΔH2=-66.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(g)、CO2的热化学方程式:___________________。
(2)如将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。
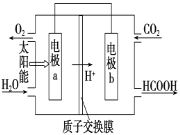
电极a、b表面发生电极反应。其中a极为:_______极,b其电极反应式为: _________________。
(3)如果用100ml 1.5mol/L的NaOH溶液吸收2.24L(标准状况)的二氧化碳气体所得溶液中各离子浓度由大到小的顺序为__________________(用离子浓度符号表示)。
(4)燃料除硫中可用到CaCO3,它是一种难溶物质,其Ksp=2.8×10—9。
①)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙及鼓入的空气反应生成石膏(CaSO4·2H2O)。写出该反应的化学方程式:_____________。
②有一纯碱溶液的浓度为2×10—4mo1/L,现将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______________________。
【答案】(除标注外,每空2分,共13分)
(1)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-793.1 kJ/mol (3分)
(2)负 CO2+2H++2e-=HCOOH
(3)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(有错计0分)
(4)① 2CaCO3+2SO2+O2+4H2O===2(CaSO4·2H2O)+2CO2 ② 5.6×10—5mo1/L
【解析】
试题分析:(1) 根据盖斯定律分析,反应①-反应②即可得热化学方程式为: CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-860.0+66.9=-793.1 kJ/mol。 (2) a极将水反应生成氧气,氧元素化合价升高,失去电子,所以为负极。b为正极,是二氧化碳得到电子生成甲酸,电极反应为:CO2+2H++2e-=HCOOH。(3) 氢氧化钠的物质的量为0.15摩尔,二氧化碳的物质的量为0.1摩尔,二者反应生成等量的碳酸钠和碳酸氢钠,因为碳酸根离子水解程度大于碳酸氢根离子,所以离子浓度顺序为: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。(4) ①碳酸钙和二氧化硫和氧气反应生成石膏和二氧化碳,方程式为: 2CaCO3+2SO2+O2+4H2O===2(CaSO4·2H2O)+2CO2 。② 根据碳酸钙的溶度积常数计算,钙离子浓度为(2.8×10—9/1×10—4)×2=5.6×10—5mo1/L。

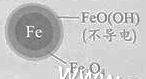
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
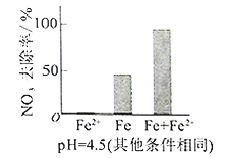
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
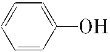
【题目】下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解 | 苯与氢气(催化剂、加热) |
C | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |
【题目】【2016届天津河东区二模】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):_____________、____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(4)一定条件下,在水溶液中1 mol E-、EOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。

(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)。