题目内容
【题目】银锌电池在商业、宇航潜艇、核武器等领域有广泛应用。一种从正极片(含Ag、Ag2O、石墨及Cu等)中回收银的流程如下,下列叙述错误的是
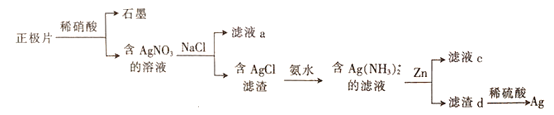
A. 滤液a中含有Na+、Cu2+、H+等阳离子
B. A用氨水溶解时发生的反应为AgCl+2NH3H2O=[Ag(NH3)2]++C1-+2H2O
C. 滤液c可浓缩结晶得到Zn(NO3)2
D. 向滤渣d中加稀硫酸可溶解其中过量的Zn
【答案】C
【解析】
正极片含Ag、Ag2O、石墨及Cu等加稀硝酸后,石墨不反应,含Ag、Ag2O、Cu和硝酸反应生成硝酸银,硝酸铜,再加氯化钠溶液会发生Ag++Cl—=AgCl![]() ,则滤液a中含有Na+、Cu2+、H+和Cl_、NO3-等离子;在含AgCl的滤渣中加入氨水会发反应生成Ag(NH3)2]C1和2H2O ,在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在, D.经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。
,则滤液a中含有Na+、Cu2+、H+和Cl_、NO3-等离子;在含AgCl的滤渣中加入氨水会发反应生成Ag(NH3)2]C1和2H2O ,在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在, D.经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。
A.正极片含Ag、Ag2O、石墨及Cu等加稀硝酸后,石墨不反应,含Ag、Ag2O、Cu和硝酸反应生成硝酸银,硝酸铜,再加氯化钠溶液会发生Ag++Cl—=AgCl![]() ,则滤液a中含有Na+、Cu2+、H+等阳离子,故A正确;B.在含AgCl的滤渣中加入氨水会发生应生成Ag(NH3)2]C1和2H2O ,即AgCl+2NH3H2O=[Ag(NH3)2]++C1-+2H2O,故B正确;C.在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在,故C错误;经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。故D正确;答案:C。
,则滤液a中含有Na+、Cu2+、H+等阳离子,故A正确;B.在含AgCl的滤渣中加入氨水会发生应生成Ag(NH3)2]C1和2H2O ,即AgCl+2NH3H2O=[Ag(NH3)2]++C1-+2H2O,故B正确;C.在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在,故C错误;经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。故D正确;答案:C。

练习册系列答案
相关题目








