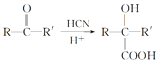题目内容
【题目】测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4 mol./L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式___________。
(2)判断滴定终点的方法是____________。
(3)③步骤中取酸性KMnO4溶液溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数_______(填“偏大”、“偏小”或“无影响”)。
(4)计算:血液中含钙离子的浓度为_____mol/L。
【答案】 2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O 当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色 偏大 2.5×10-3
【解析】(1)用酸性KMnO4溶液滴定H2C2O4溶液,高锰酸钾具有强氧化性能氧化草酸生成CO2、Mn2+,配平可得离子方程式。故答案为:2MnO4﹣+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O;
(2)H2C2O4反应完之前,溶液是无色的,当草酸与高锰酸钾恰好完全反应,再滴高锰酸钾,溶液瞬间变为紫红色,此为滴定终点。故答案为:当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色;
(3)装液前滴定管需要润洗,若没有润洗,则滴定管中残留蒸馏水将高锰酸钾溶液稀释,所以滴定过程中消耗高锰酸钾溶液体积增大,计算测得的血钙质量分数偏大。
故答案为:偏大;
(4)根据定量关系可知,5CaC2O4~5H2C2O4~2KMnO4,
5 2
n 0.020L×l.0×l0﹣4 mol/L
所以,n=5.0×10﹣6mol,钙离子的浓度= ![]() ;
;
故答案为:2.5×10﹣3。