题目内容
【题目】钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图:

回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:__________________。
(2)第②步操作所后的滤液中,溶质有Na2MoO4、_________和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是___________________。
(3)第③步操作H2SO4需要适量,通常是通过_________来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化__________(填“较大”或“较小”)。
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:_________________。
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为_______。
【答案】(1)MoO3+Na2CO3![]() Na2MoO4+CO2↑;
Na2MoO4+CO2↑;
(2)NaAlO2;取少量滤渣洗涤液于试管中滴加几滴KSCN溶液,若溶液变红,则证明含+3价铁;
(3)测溶液的pH值;较小;
(4)4Al+2MoO3![]() 2Mo+2Al2O3;
2Mo+2Al2O3;
(5)3:1;
【解析】
试题分析:(1)MoO3、Al2O3与Na2CO3的反应和SiO2与Na2CO3的反应相似,加入碳酸钠焙烧时可生成Na2MoO4和NaAlO2,MoO3与Na2CO3反应的化学方程式为MoO3+Na2CO3![]() Na2MoO4+CO2↑,故答案为:MoO3+Na2CO3
Na2MoO4+CO2↑,故答案为:MoO3+Na2CO3![]() Na2MoO4+CO2↑;
Na2MoO4+CO2↑;
(2)高温条件下,氧化铝和碳酸钠反应生成Na2AlO2,滤液中含有焙烧后生成Na2MoO4、Na2AlO2以及过量的Na2CO3,检验第②步操作所得滤渣中含有三价铁,取少量滤渣洗涤液于试管中滴加几滴KSCN溶液,若溶液变红,则证明含三价铁,故答案为:Na2AlO2;取少量滤渣洗涤液于试管中滴加几滴KSCN溶液,若溶液变红,则证明含三价铁;
(3)第③步操作H2SO4需要适量,避免氢氧化铝溶解,通常是通过测溶液的pH来调控H2SO4的用量,转化关系中④蒸发结晶溶液得到硫酸钠晶体和Na2MoO4溶液,与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化较小,硫酸钠溶解度收温度影响大,先析出晶体,故答案为:测溶液的pH;较小;
(4)MoO3发生铝热铝反应,高温下和铝反应生成钼和氧化铝,反应的化学方程式为:4Al+2MoO3![]() 2Mo+2Al2O3,故答案为:4Al+2MoO3
2Mo+2Al2O3,故答案为:4Al+2MoO3![]() 2Mo+2Al2O3;
2Mo+2Al2O3;
(5)加入稀硫酸后,滤渣为Al(OH)3,滤液中含有Na2SO4和Na2MoO4,已知:n(Na2CO3)=![]() =0.05mol,n(Na2SO4)=
=0.05mol,n(Na2SO4)=![]() =0.045mol,则由Na守恒可知n(Na2MoO4)=0.005mol,2.34gAl(OH)3的物质的量为
=0.045mol,则由Na守恒可知n(Na2MoO4)=0.005mol,2.34gAl(OH)3的物质的量为![]() =0.03mol,根据Al元素守恒,Al2O3的物质的量为0.015mol,因此,Al2O3、MoO3的物质的量之比为0.015mol:0.005mol=3:1,故答案为:3:1。
=0.03mol,根据Al元素守恒,Al2O3的物质的量为0.015mol,因此,Al2O3、MoO3的物质的量之比为0.015mol:0.005mol=3:1,故答案为:3:1。

【题目】在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
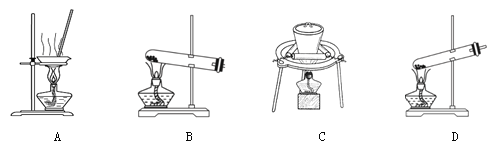
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论: 。 |
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察; | 现象: ; 结论:样品中含有NaHCO3。 |
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察。 | 现象: ; 结论: 。 |




