题目内容
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。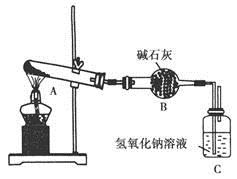
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4
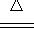 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑B.3CuSO4
 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑C.5CuSO4
 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑D.6CuSO4
 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
A
解析

练习册系列答案
相关题目
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A.常温常压下,1.7gH2O2中含有的电子数为0.9NA |
| B.1 mol.L-1CuCl2溶液含有2NA个Cl- |
| C.1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子 |
| D.标准状况下,2.24L戊烷所含分子数为0.1NA |
下列有关化学用语或名称表达正确的是
A.亚硫酸的电离方程式:H2SO3 2H++SO32- 2H++SO32- |
B.乙炔的分子结构模型示意图: |
C.H2O2的电子式: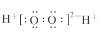 |
D. 的名称3-甲基-1-丁醇 的名称3-甲基-1-丁醇 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,44 g CO2含有nA个C原子 |
| B.1 L 0.1 mol·L-1 Na2S溶液中含有0.1 nA个S2— |
| C.0.1 mol Na与足量O2反应,转移0.2 nA个电子 |
| D.标准状况下,22.4 L 的CCl4含有4 nA个Cl原子 |
若两物质恰好完全反应,下列各项中反应前后保持不变的是
①电子总数;②原子总数;③分子总数;④物质的总能量;⑤物质的总质量
| A.①②⑤ | B.①③⑤ | C.②③④ | D.②④⑤ |
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
| A.3.2 g | B.4.0 g | C.4.2 g | D.4.6 g |
下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是
| 溶液 | KOH | HNO3 | CH3COOH | HCl |
| 溶质质量分数w(%) | 56 | 63 | 60 | 36.5 |
| 物质的量浓度c(mol·L-1) | 14.3 | 13.8 | 10.6 | 11.8 |
A.HCl B.HNO3 C.CH3COOH D.KOH
下列有关化学用语表示正确的是
①CSO的电子式: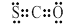
②对硝基苯酚的结构简式: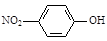
③Cl-的结构示意图: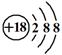
④甲烷分子的比例模型:
⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子: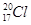
⑦ HCO3-的水解方程式为:HCO3-+H2O CO32-+H3O+
CO32-+H3O+
| A.①④⑤ | B.②③④⑥ | C.③⑤⑥⑦ | D.全部正确 |
在标准状况下,用干燥烧瓶收集一瓶氯化氢气体倒置于盛水的水槽中时,水充满烧瓶(假设烧瓶里溶液不扩散出水槽),烧瓶里盐酸的密度为ρ g·cm-3。该盐酸的物质的量浓度、溶质的质量分数分别为( )。
A.c=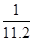 mol·L-1、w= mol·L-1、w=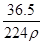 % % |
B.c=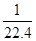 mol·L-1、w= mol·L-1、w=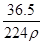 % % |
C.c=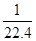 mol·L-1、w= mol·L-1、w=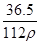 % % |
D.c=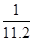 mol·L-1、w= mol·L-1、w=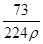 % % |