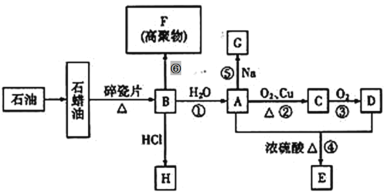
题目内容
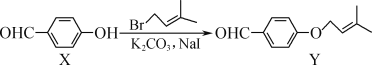
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
A. 原子半径:Z>Y>X
B. Y和Z两者最高价氧化物对应水化物能相互反应
C. WX3和水反应形成的化合物是离子化合物
D. 气态氢化物的稳定性:R<W
【答案】B
【解析】
根据元素的化合价变化规律可知,X是氧元素,Y是钠元素,Z是铝元素,W是硫元素,R是氯元素。
A. 同周期自左向右原子半径逐渐减小,即原子半径:Y>Z>X,故A错误;
B. Y是钠元素,Z是铝元素,Y和Z两者最高价氧化物对应水化物分别是氢氧化钠和氢氧化铝,氢氧化铝是两性氢氧化物,能和氢氧化钠溶液反应,生成偏铝酸钠和水,故B正确;
C. W是硫元素,X是氧元素,SO3和水反应形成的化合物是共价化合物硫酸,故C错误;
D. R是氯元素,W是硫元素,氯元素的非金属性强于S元素的,则H2S的稳定性弱于HCl的稳定性,气态氢化物的稳定性:R>W,故D错误;
答案选B。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】设反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)若500 ℃时进行反应①,CO2的转化率为_______________。
(2)900 ℃时进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=______________。
H2O(g)+CO(g),其平衡常数K3=______________。
(3)反应②的焓变ΔH____________(填“>”、“<”或“=”)0。
(4)700 ℃时反应②达到化学平衡,要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施有___________________________________。
A.缩小容器容积 B.加入更多的水蒸气
C.升高温度至900 ℃ D.使用合适的催化剂
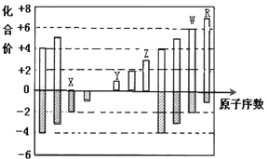
(5)下列图像符合反应①的是________________________。
【题目】某实验小组对H2O2分解反应进行实验探究:将质量相等状态不同的MnO2分别加入盛有等体积等浓度的H2O2溶液的大试管中,并用带火星的木条在试管口测试。有关记录如下:
MnO2 | 触摸试管 | 现象 | 反应时间/min |
粉末 | 发烫 | 反应剧烈,带火星的木条迅速复燃 | t1 |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | t2 |
(1)试管中化学反应方程式:____________。
(2)实验结果证明了催化剂的催化效果与____________有关。
(3)表中t1____________t2(填写“>”、“<”或“=”)
(4)控制该反应速率,除了改变催化剂因素,可行的方法还有____________。
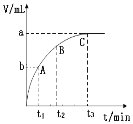
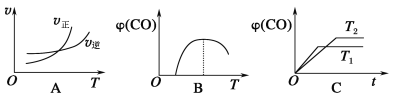
(5)某同学用一定浓度的H2O2溶液10mL,加入适量MnO2在某温度下反应,测量放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是____________点。