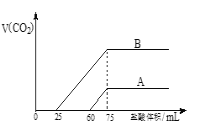
题目内容
【题目】设反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
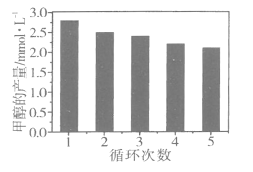
(1)若500 ℃时进行反应①,CO2的转化率为_______________。
(2)900 ℃时进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=______________。
H2O(g)+CO(g),其平衡常数K3=______________。
(3)反应②的焓变ΔH____________(填“>”、“<”或“=”)0。
(4)700 ℃时反应②达到化学平衡,要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施有___________________________________。
A.缩小容器容积 B.加入更多的水蒸气
C.升高温度至900 ℃ D.使用合适的催化剂
(5)下列图像符合反应①的是________________________。
【答案】50% 1.50 < B A
【解析】
根据勒夏特列原理判断温度升高时,反应平衡常数变化与反应热的对应关系,并基于反应热分析使平衡正向移动的条件,据此回答问题。
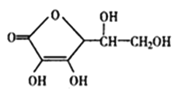
(1)若500 ℃时进行反应①,反应平衡常数K=![]() ,即反应生成的一氧化碳的浓度等于反应剩余的二氧化碳的浓度,根据气体反应系数比为1:1可知,CO2的转化率为50%。
,即反应生成的一氧化碳的浓度等于反应剩余的二氧化碳的浓度,根据气体反应系数比为1:1可知,CO2的转化率为50%。
(2)900 ℃时进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=
H2O(g)+CO(g),其平衡常数K3=![]() 。
。
(3)根据表格可知,温度升高,反应平衡常数减小,反应逆向移动,正反应为放热反应,故反应②的焓变ΔH< 0。
(4)700 ℃时反应②达到化学平衡,该反应正反应放热,且反应前后气体体积不变,故要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施为B。
A.缩小容器容积,不改变平衡状态,A错误;
B.加入更多的水蒸气 ,增大反应物,平衡正向移动,B正确;
C.升高温度至900 ℃,根据勒夏特列原理,反应逆向移动,C错误;
D.使用合适的催化剂,不改变反应平衡,D错误。
答案为B。
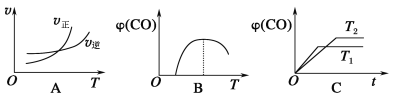
(5)反应①温度升高,平衡常数增大,反应正向移动,正反应为吸热反应,且反应前后气体体积不变,故:
A. 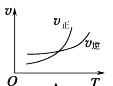 温度升高,正反应速率大于逆反应速率,反应正向移动,符合反应①;
温度升高,正反应速率大于逆反应速率,反应正向移动,符合反应①;
B. 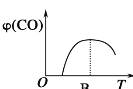 在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图像表示正反应为放热反应,不符合反应①;
在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图像表示正反应为放热反应,不符合反应①;
C.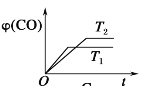 到达平衡的时间越短,速率越快,温度越高,说明T1温度高于T2,但T1的一氧化碳含量低于T2,平衡向逆反应方向移动,说明反应正方向放热,不符合反应①。
到达平衡的时间越短,速率越快,温度越高,说明T1温度高于T2,但T1的一氧化碳含量低于T2,平衡向逆反应方向移动,说明反应正方向放热,不符合反应①。
答案为A。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案