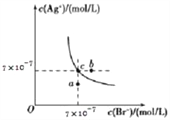
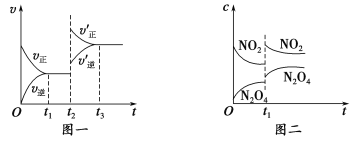
题目内容
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
根据上述数据:甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为____________________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_______(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填“甲”或“乙”判断正确。试剂X是_____________(填序号)。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH_____(填“高于”、“低于”或“等于”)8.3,则_____(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言_____(填“甲”或“乙”)判断是错误的,理由是_____________________________________________________。
【答案】 HCO3-+H2O![]() H2CO3+OH- 大于 乙 B 等于 甲 乙 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
H2CO3+OH- 大于 乙 B 等于 甲 乙 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
【解析】试题分析:根据上述数据:甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为HCO3-+H2O![]() H2CO3+OH-。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于NaHCO3。
H2CO3+OH-。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于NaHCO3。
(1)只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生白色沉淀(碳酸钡),则乙判断正确。试剂X是BaCl2溶液。
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言甲和乙判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
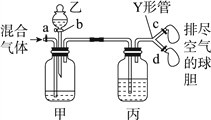
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D