题目内容
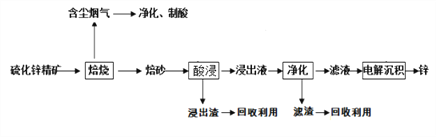
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:

已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式_____________;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;

⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是___________________________________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500molL-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
【答案】⑴MnO2+H2O +e-= MnOOH+OH-
⑵ 适当的升温(或搅拌)
⑶将溶液中的Zn2+转化为ZnS沉淀而除去
⑷趁热过滤
⑸H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑ 或
H2O2+ 2MnOOH+2H2SO4=2MnSO4+4H2O+O2↑
⑹Na2CO3溶液的碱性强,容易产生Mn(OH)2的沉淀
⑺25.2%
【解析】⑴锌粉为负极,发生氧化反应,氢氧化钾溶液为电解质时发生的电极反应式为Zn+4OH--2e-= ZnO22-+2H2O,用电池总反应2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2减去负极电极反应,即得电池的正极反应式为MnO2+H2O +e-= MnOOH+OH-;
⑵通过适当的升温、固体粉碎或搅拌等措施可提高碳包的浸出效率;
⑶滤液1含有Zn2+,遇加入的MnS可以生成ZnS沉淀,再通过过滤即可除去;
⑷有MnSO4的溶解度曲线可知MnSO4·H2O在温度超过40℃后溶解度随温度的升高而降低,则将滤液2溶液蒸发结晶、趁热过滤、洗涤、并低温干燥防分解即可得到MnSO4·H2O晶体;
⑸由表1可知选用30%的过氧化氢获得的MnSO4质量最高,则30%的过氧化氢为最佳试剂,与MnO2在酸性条件下发生反应的化学方程式为H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑或
H2O2+ 2MnOOH+2H2SO4=2MnSO4+4H2O+O2↑;
⑹相同浓度的NaHCO3溶液和Na2CO3溶液,因CO32-的水解能力强于HCO3-,Na2CO3溶液的碱性强,更容易产生Mn(OH)2的沉淀;
⑺消耗EDTA的物质的量为0.0500molL-1×0.022L=0.0011mol,则样品中Mn2+的物质的量为0.0011mol×![]() =0.11mol,Mn元素的百分含量为
=0.11mol,Mn元素的百分含量为![]() ×100%=25.2%。
×100%=25.2%。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2 SO2(g)+ O2(g)![]() 2SO3(g) △H<0。得到如表中的两组数据:
2SO3(g) △H<0。得到如表中的两组数据:
实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法不正确的是( )
A. 实验1在前6min的平均反应速率υ(SO2)=0.2 mol·L-1·min-1
B. T1、T2的关系:T1 > T2
C. K1、K2的关系:K2>K1
D. x= 1.6,y=0.2 ,t<6