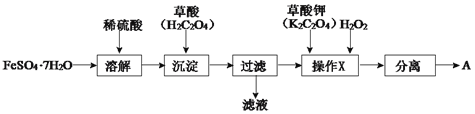
题目内容
【题目】I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84 kJ/mol 2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol。工业上常以甲醇为原料制取甲醛,请写出 CH3OH (g)与O2 (g)反应生成HCHO(g)和H2O(g)的热化学方程式:_______________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
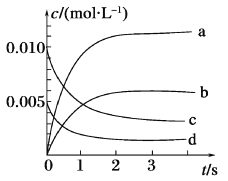
(1)如图所示,表示NO2变化曲线的是_______,用O2表示从0~2 s内该反应的平均速率v=_______。
(2)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变
【答案】 2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH=-316 kJ·mol-1 CH3OH-6e-+8OH- = 6H2O b 1.25×10-3mol·(L·s)-1 bc
【解析】I.(1)已知①CH3OH(g)=HCHO(g)+H2(g) △H=+84 kJ/mol ;②2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol。由①![]() ②得2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g),ΔH=(+84 kJ/mol)
②得2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g),ΔH=(+84 kJ/mol)![]() +(-484 kJ/mol)= -316 kJ·mol-1。所以 CH3OH (g)与O2 (g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH=-316 kJ·mol-1。
+(-484 kJ/mol)= -316 kJ·mol-1。所以 CH3OH (g)与O2 (g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH=-316 kJ·mol-1。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,电极反应为2CH3OH+3O2+4OH- = 2 CO32-+6H2O,正极的反应式为3O2+6 H2O +12e- =12OH-。该电池负极的电极反应式为CH3OH-6e-+8OH- = 6H2O。
Ⅱ.由表中数据可知,反应从正反应开始发生,NO的物质的量逐渐减小,到第3s达到平衡,NO的变化量为0.013mol,所以NO2的变化量也是0.013mol,NO2的平衡浓度是0.0065mol/L。
(1)表示NO2变化曲线的是b,用O2表示从0~2 s内该反应的平均速率v(O2)= ![]() v(NO)=
v(NO)= ![]() 1.25×10-3mol·(L·s)-1 。
1.25×10-3mol·(L·s)-1 。
(2)a.v(NO2) =2V(O2),不能说明正反应速率和逆反应速率相等;b.该反应是一个气体分子数减少的反应,所以容器内压强是一个变量,当容器内压强保持不变时反应达到平衡;c.反应混合物中只有二氧化氮是有色气体,当二氧化氮的浓度不再变化时,体系颜色就不再改变,反应达到平衡;d.在反应过程中气体的质量和体积都保持不变,所以容器内密度保持不变,无法判断反应是否达到平衡。综上所述,能说明该反应已达到平衡状态的是bc。