题目内容
【题目】化合物A[KxFe(C2O4)y·zH2O,其中铁元素为+3价]是一种重要的光化学试剂。
(1)制备化合物A的实验流程如下:
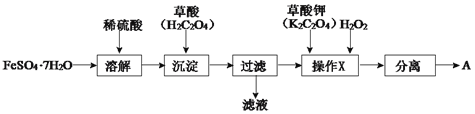
①上述流程中,检验“过滤”后的固体已洗涤干净的方法是____。
②上述流程“操作X”中加入H2O2的目的是____。
(2)测定化合物A的化学式实验步骤如下:
a、准确称取A样品4.91g,干燥脱水至恒重,残留物质的质量为4.37g;
b、将步骤a所得固体溶于水,加入还原铁粉0.28g,恰好完全反应;
c、另取A样品4.91g置于锥形瓶中,加入足量的3 mol/L的H2SO4溶液和适量蒸馏水,再加入0.50mol/L的KMnO4溶液24.0 mL,微热,恰好完全反应:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。
请通过计算填空:
①4.91g A样品中含结晶水的物质的量为____mol。
②A样品中![]() =____。
=____。
③A的化学式为____。
【答案】 取少量最后一次洗涤液于试管中,滴加BaCl2溶液,无白色沉淀,说明已洗涤干净。 把Fe2+全部氧化成Fe3+ 0.03 1:3 K3Fe(C2O4)3·3H2O
【解析】试题分析:(1) 因为最后制取的A中铁为+3价,所以加入H2O2的目的为把Fe2+氧化成Fe3+;
(2)n(H2O)=(4.91g-4.37g)/18g/mol="0.03mol;"
n(Fe3+)="2n(Fe)=2×0.28g/56g/mol=0.01mol;"
由题给方程式确定n(C2O42-)=5/2×n(KMnO4)=" 5/2" ×0.50molL-1×0.024L=0.03mol
n(Fe3+)/n (C2O42-)=1:3
根据离子电荷守恒:n(K+)+3n(Fe3+)="2n" (C2O42-) 得n(K+)=0.03mol
因此A为 K3Fe(C2O4)3·3H2O

【题目】I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84 kJ/mol 2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol。工业上常以甲醇为原料制取甲醛,请写出 CH3OH (g)与O2 (g)反应生成HCHO(g)和H2O(g)的热化学方程式:_______________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图所示,表示NO2变化曲线的是_______,用O2表示从0~2 s内该反应的平均速率v=_______。
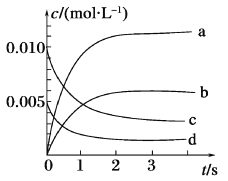
(2)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变