题目内容
3.下列电离方程式中,正确的是( )| A. | NaHCO3═Na++H++CO32- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | NH3•H2O═NH4++OH- |
分析 A.碳酸氢根离子不能拆开,应该保留整体形式;
B.电离方程式中电荷不守恒,氢氧化钡电离出2个氢氧根离子;
C.硫酸铝为强电解质,在溶液中完全电离出铝离子和硫酸根离子;
D.一水合氨为弱碱,在溶液中部分电离出铵根离子和氢氧根离子,应该使用可逆号.
解答 解:A.碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,NaHCO3在水中正确的电离方程式为:NaHCO3=Na++HCO3-,故A错误;
B.氢氧化钡为强电解质,在溶液中完全电离出钡离子和氢氧根离子,其正确的电离方程式为:Ba(OH)2═Ba2++2OH-,故B错误;
C.硫酸铝在溶液中完全电离出铝离子、硫酸根离子,其电离方程式为:Al2(SO4)3═2Al3++3SO42-,故C正确;
D.一水合氨在溶液中存在电离平衡,其正确的电离方程式为:NH3•H2O═NH4++OH-,故D错误;
故选C.
点评 本题考查了电离方程式的书写判断,题目难度中等,明确电离方程式的书写原则为解答关键,注意掌握强弱电解质的概念及判断方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
13.下列有关甲苯的说法中,不正确的是( )
| A. | 可以制造烈性炸药TNT | B. | 可以与氢气发生加成反应 | ||
| C. | 可以与溴水发生取代反应 | D. | 可以被高锰酸钾酸性溶液氧化 |
14.在试剂①浓氨水②氯水③硝酸银④浓硝酸⑤浓盐酸中,必须用棕色瓶保存的是( )
| A. | 全部 | B. | ②③④ | C. | ②③⑤ | D. | ①③④ |
11.下列有关叙述正确的是( )
| A. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| B. | 含有金属阳离子的晶体不一定是离子晶体 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |
18.下列物质存放方法错误的是( )
| A. | 浓硝酸、氯水保存在棕色试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的金属钠存放于煤油中 |
8.需要加入适当的氧化剂才能实现的是反应是( )
| A. | 浓HCl→Cl2 | B. | MnO2-→Mn2+ | C. | SO2→HSO3- | D. | Al(OH)3→AlO2- |
12.如图为中学化学实验中的常见实验装置
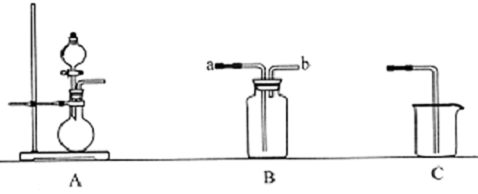
(1)装置A可用于制备多种气体.请写出用A装置制备下列气体时.圆底烧瓶和分液漏斗中应装入的化学试剂.
(2)装置B收集多种气体,若要用于收集氨气.则进气管为b(填字母):
若要收集NO,简述用装置B收集NO的方法将B瓶中装满水,塞上橡皮塞,从b口通入NO气体,将水从a口排出.
(3)现要用上述装置制取Cl2设计实验比较氯元素和硫元索的非金属性的强弱.请在表格内依次填上所需的装置和所发生的离子反应方程式(可不填满).

(1)装置A可用于制备多种气体.请写出用A装置制备下列气体时.圆底烧瓶和分液漏斗中应装入的化学试剂.
| 气体 | O2 | CO2 | NH3 |
| 试剂 |
若要收集NO,简述用装置B收集NO的方法将B瓶中装满水,塞上橡皮塞,从b口通入NO气体,将水从a口排出.
(3)现要用上述装置制取Cl2设计实验比较氯元素和硫元索的非金属性的强弱.请在表格内依次填上所需的装置和所发生的离子反应方程式(可不填满).
| 装置 | 离子方程式 |
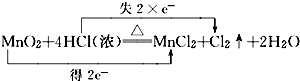 ,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol
,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol