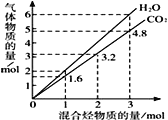
��Ŀ����
����Ŀ�������£���Cl2����ͨ��100 mLˮ�������ͣ�Ȼ�������ñ�����ˮ����μ���0.1 mol��L��1 NaOH��Һ������������pH�ı仯��ͼ��ʾ�������й�������ȷ����
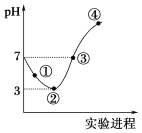
A. ���ߢۢܶ������ӷ�Ӧ��HClO��OH��===ClO����H2O
B. �����ݢڴ����ݼ������ܽ��n(Cl2)
C. �۴���ʾ����������������Һǡ�÷�Ӧ��ȫ
D. �ٴ�c(H��)ԼΪ�ڴ�c(H��)������
���𰸡�A
��������
����A�����ߴ���������ҺpH����˵���˶η�����Ӧ��HCl+NaOH�TNaCl+H2O��HClO+NaOH�TNaClO+H2O�����ӷ�Ӧ�ֱ�Ϊ��H++OH-��H2O��HClO+OH-�TH2O+ClO-�������ʱc��H+��=c��OH-����c��Na+��=c��Cl-��+c��ClO-����HClOΪ������ʣ����ֵ��룬��ʱ��Һ�д��ڴ�����ĵ���ƽ�⣬��������ͼ�������֪����ҺpH����������pH����7���������������ƣ��������ƺʹ����ᷴӦ��HClO+NaOH�TNaClO+H2O�����ɵĴ�������Ϊǿ�������Σ�ˮ��ʼ��ԣ��Ӽ�ֱ�������pH���������������ӷ�ӦΪHClO+OH����ClO��+H2O��A��ȷ��B��������ʾ��Һ�з�����Ӧ��Cl2+H2O![]() H++Cl-+HClO��HClOΪ������ʣ����ֵ��룬������pH����μӷ�Ӧ��������B����C����������������ǡ�÷�Ӧ��ȫ��ҺΪ�Ȼ��ơ�����������Һ����Һ�ʼ��ԣ�������ʾ��Һ�з�����Ӧ��HCl+NaOH�TNaCl+H2O��HClO+NaOH�TNaClO+H2O����Һ�����ԣ�c��H+��=c��OH-����C����D���������������������ܽ�ƽ�⣺Cl2+H2O
H++Cl-+HClO��HClOΪ������ʣ����ֵ��룬������pH����μӷ�Ӧ��������B����C����������������ǡ�÷�Ӧ��ȫ��ҺΪ�Ȼ��ơ�����������Һ����Һ�ʼ��ԣ�������ʾ��Һ�з�����Ӧ��HCl+NaOH�TNaCl+H2O��HClO+NaOH�TNaClO+H2O����Һ�����ԣ�c��H+��=c��OH-����C����D���������������������ܽ�ƽ�⣺Cl2+H2O![]() H++Cl-+HClO���ҽ��еĹ��̣���������ǿ��������Ũ��������D����ѡA��
H++Cl-+HClO���ҽ��еĹ��̣���������ǿ��������Ũ��������D����ѡA��

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�����Ŀ����һ���¶��£�10mL0.40mol/LH2O2��Һ�������ֽ⣬��ͬʱ�̲������O2�����(������Ϊ��״��)���±���������Һ����仯��������������ȷ����( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A. 2 minʱH2O2��Ũ��c(H2O2)��0.314mol/L
B. 0��4 min��ƽ����Ӧ����v(H2O2)��3.75��10-2mol/(L��min)
C. 6��10 min�����������ƽ����Ӧ����v(H2O2)��2.75��10-2mol/(L��min)
D. ��Ӧ��6 minʱ��H2O2�ֽ���50%