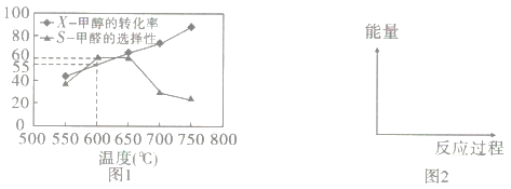
题目内容
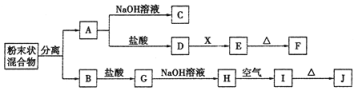
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。
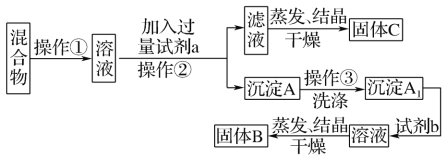
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。试回答下列问题:
(1)操作①的名称是____,操作②的名称是____。
(2)试剂a是_____(填化学式,下同),试剂b是____,固体B是____。
(3)加入试剂a所发生反应的化学方程式为_____。加入试剂b所发生反应的离子方程式为_____。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进?_____(若能,此问不用回答)。
【答案】溶解 过滤 K2CO3 HCl BaCl2 K2CO3+BaCl2=BaCO3↓+2KCl Ba2++2H+=Ba2++CO2↑+H2O 不能 应在操作②的滤液中加入过量盐酸后再蒸发结晶
【解析】
KCl和BaCl2两种固体混合物加水溶解得到两者混合溶液,加过量K2CO3溶液得BaCO3沉淀,再加稀盐酸,得氯化钡溶液蒸发结晶可得氯化钡固体,滤液中含KCl和K2CO3,据此回答。
(1)KCl和BaCl2两种固体混合物加水溶解得到两者混合溶液,故操作①为溶解,加过量K2CO3溶液得BaCO3沉淀和滤液,故操作②为过滤。
故答案为:溶解;过滤;
(2)试剂a是K2CO3溶液;试剂b是稀盐酸,与Ba2CO3反应生成BaCl2;固体B是BaCl2。
故答案为:K2CO3;HCl;BaCl2;
(3)加入试剂a所发生反应的化学方程式为:K2CO3+BaCl2=BaCO3↓+2KCl;加入试剂b所发生反应的离子方程式为Ba2++2H+=Ba2++CO2↑+H2O。
故答案为:K2CO3+BaCl2=BaCO3↓+2KCl;Ba2++2H+=Ba2++CO2↑+H2O;
(4)由于滤液中含有过量得K2CO3,故滤液直接蒸发结晶后不能得到纯净的KCl,需先加入过量盐酸后再蒸发结晶。
故答案为:不能;应在操作②的滤液中加入过量盐酸后再蒸发结晶。

 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案