题目内容
1.油脂是高级脂肪酸甘油酯,在工业上用途广泛.(1)以硬脂酸甘油酯为例写出油脂的皂化反应方程式为
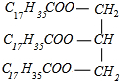 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+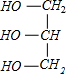
(2)从皂化反应后的溶液中提取肥皂和甘油的过程如下:
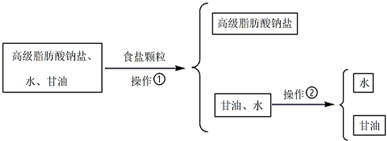
加入食盐颗粒后,液体表面析出白色固体,则食盐的作用是降低高级脂肪酸钠盐的溶解度.
分析 (1)硬脂酸甘油酯在碱性条件下发生皂化反应,硬脂酸甘油酯与氢氧化钠反应生成C17H35COONa与甘油;
(2)在皂化反应后的混合物中加食盐可以降低高级脂肪酸钠的溶解度.
解答 解:(1)硬脂酸甘油酯与氢氧化钠反应生成C17H35COONa与甘油,反应方程式为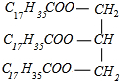 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+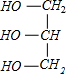 .
.
故答案为: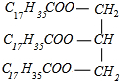 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+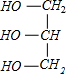 ;
;
(2)在皂化反应后的混合物中加食盐可以降低高级脂肪酸钠的溶解度,高级脂肪酸钠以固体的形式析出,所以液体表面析出白色固体;
故答案为:降低高级脂肪酸钠盐的溶解度.
点评 本题考查了方程式的书写,根据物质的性质和化学方程式的书写方法即可解答,掌握基础是关键,题目较简单.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
19.下列说法正确的是( )
| A. | 直径介于1 nm~100 nm之间的微粒称为胶体 | |
| B. | 制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 渗析是鉴别溶液和胶体的最简便的方法 |
12.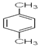 2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
 2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )| A. | PX是一种有机化合物 | |
| B. | 仅由碳、氢两种元素组成 | |
| C. | 爆炸燃烧的产物是可能是CO2和H2O | |
| D. | 该有机化合物分子中存在碳碳单键,也存在碳碳双键 |
9.氯霉素是一种常见的药物,实验发现由于其分子结构中含有羟基而具有苦味.但如果将其分子中碳链末端的羟基中的氢原子换成来自棕榈酸中的原子团 后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
 后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 无味氯霉素的水溶性变差,所以苦味消失 | |
| B. | 无味氯霉素失去了药性,所以苦味消失 | |
| C. | 无味氯霉素是棕榈酸的盐类 | |
| D. | 无味氯霉素在人体内不会发生水解 |
16.下列实验能够实现的是( )
| A. | 实验室制取乙烯时用酸性高锰酸钾溶液检验产物 | |
| B. | 除乙酸乙酯中少量的乙酸用足量氢氧化钠溶液充分反应后分液即可 | |
| C. | 检验淀粉水解是否完全将水解液中加碱至碱性后加入碘水 | |
| D. | 苯、硝基苯、乙醇、乙酸四种物质只用碳酸氢钠溶液一种试剂就能鉴别 |
6.日本冈山大学教授滨田博喜和研究员富良德等通过实验发现,桉树叶子的培养细胞能够消除有害化学物质双酚A的毒性.双酚A的结构简式如图所示,下列有关此物质的说法正确的是( )


| A. | 1 mol该物质与足量溴水反应消耗2 mol Br2 | |
| B. | 该物质能与碳酸氢钠溶液反应放出CO2 | |
| C. | 该物质的所有碳原子可能在同一平面 | |
| D. | 该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2 |
13.下列各组互为同系物的是( )
| A. | CH3( CH2)2 CH3 和 CH3 CH=CH CH3 | |
| B. | CH3( CH2)2 CH3 和 CH3 CH2 CH( CH3) CH2 CH3 | |
| C. | CH3 C≡C CH3 和CH2=CH CH=CH2 | |
| D. | CH3 C≡C CH3 和 CH3 CH=CH CH3 |
 如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式:
如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式: