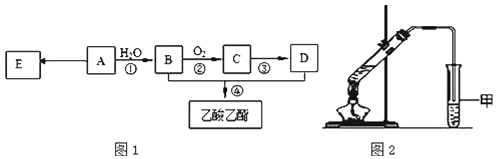
题目内容
【题目】下列共价键的键能最大的是( )
A. H—F B. H—O C. H—N D. H—C
【答案】A
【解析】原子半径越小,键长越短,同周期元素原子从左到右原子半径依次减小,半径由大到小为C>N>O>F,故H-F键长最短,键能最大,答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】四种短周期元素在周期表中的位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中第_____周期,_____族;
(2)比较X与Y的气态氢化物的稳定性:_____(写化学式);
(3)XW2的电子式为_____;
(4)比较X、Y、Z、W四种原子半径由大到小关系:_____;
(5)X和W形成的化合物属于_____ (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:_____.
【题目】NO2为红棕色气体,可在火箭燃料中作氧化剂。回答下列问题:
(1)火箭用N2H4和NO2作燃料,产物绿色无污染,该反应的化学方程式为____________。
(2)为探究NO2和铁粉反应的产物,某小组按下图所示装置进行实验。
已知:①二者反应可能的还原产物为N2或NO
②沸点:NO2(21℃),NO(-152℃)
③酸性KMnO4溶液能氧化NO生成NO3-
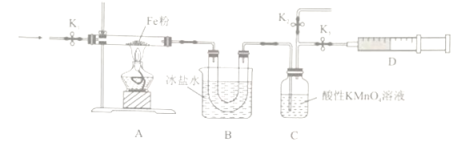
①按上图所示组装完实验仪器后,下一步操作为______________________________。
②实验前需利用气体X将装置的空气排净,气体X可以为_______(填标号)。
A.Ar B.H2 C.CO D.NO2
③排净空气后,后续实验的最佳操作顺序是___c、b(填标号)。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开K1和K2,关闭K3,缓缓通入气体X
d.打开K1和K3,关闭K2,缓缓通入NO2 e.关闭K1,停止通入NO2
④装置B的作用是__________________________________。
(3)分析NO2和铁粉反应的产物
①实验过程中A、C装置的物质均无明显颜色变化,D收集到无色气体。由此可推知气体产物为____________________________。
②取少量固体产物于试管,先加入盐酸充分溶解,再加入KSCN溶液,溶液若无血红色,则产物不含三价铁。该方案是否可行并说明理由:_______________________________。
③实验得到的相关数据如下表:
玻璃管质量/g | Fe质量/g | 反应后(玻璃管+固体)/g |
m | 1.12 | m+1.52 |
综合实验现象和计算可知,固体生成物一定有______(填“FeO”Fe2O3”或“Fe3O4”);反应的方程式为______
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是 , 溶液中各离子浓度大小的关系是。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.01mol·L-1以上,则溶液中CO32-物质的量浓度应 ≥mol·L-1。