��Ŀ����
����Ŀ����֪ͭ�������A���ṹ��ͼ1������ش��������⣺ 
��1��Cu�ļ����Ų�ʽΪ ��
��2��A��������Ԫ��C��N��O�ĵ�һ�������ɴ�С��˳��Ϊ �� ���е�ԭ�ӵ��ӻ��������Ϊ
��3�����就���������H2NCH2COO�������ȷֽ�ɲ���CO2��N2 �� N2�ЦҼ��ͦм���Ŀ֮������N2O��CO2��Ϊ�ȵ����壬��N2O������Oֻ��һ��N��������N2O�ĵ���ʽΪ ��
��4����Cu���£��״��ɱ�����Ϊ��ȩ��HCHO������ȩ������HCO�ļ�����ѡ����ڡ��������ڡ���С�ڡ���120�㣻��ȩ����ˮ�γ����������ͼ2�б�ʾ���� ��
��5��������������ͼ3������ʯ�ṹ���ƣ��dz�Ӳ���ϣ���������������B��N��������ԭ����֮��Ϊ���ṹ��ѧ����ԭ�����������ʾ�����ڲ���ԭ�ӵ����λ�ã���ͼ4����������ľ����У�Bԭ�ӵ���������ֱ��У�B��0��0��0����B�� ![]() ��0��
��0�� ![]() ����B��
����B�� ![]() ��
�� ![]() ��0���ȣ��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ ��
��0���ȣ��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ ��
���𰸡�
��1��[Ar]3d104s1
��2��N��O��C��sp3
��3��1��2��![]()
��4�����ڣ�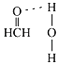
��5��1��1���� ![]() ��
�� ![]() ��
�� ![]() ��
��
���������⣺��1��Cuԭ�Ӻ�����29�����ӣ����ݹ���ԭ����д���̬ԭ�Ӻ�������Ų�ʽΪ[Ar]3d104s1 �� ���Դ��ǣ�[Ar]3d104s1����2��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�����������Ԫ�ص�һ�����ܴ�С˳����N��O��C��Nԭ�Ӽ۲���ӶԸ�����4�����ݼ۲���ӶԻ��������ж�Nԭ���ӻ���ʽΪsp3 ��
���Դ��ǣ�N��O��C��sp3����3��N2�ЦҼ��ͦм���Ŀ֮��Ϊ1��2���ȵ�����ṹ���ƣ����ݶ�����̼����ʽ��дN2O�ĵ���ʽΪ ![]() �����Դ��ǣ�1��2��
�����Դ��ǣ�1��2�� ![]() ����4����ȩ��C��sp2�ӻ���C��H��C��H���н���������120�ȣ����������ʻ����ŶԵ��ӵ��ų⣬ʵ�ʼ���Ӧ����С��120�ȣ����Լ�ȩ������HCO�ļ��Ǵ���120�ȣ���ȩ�����е�Oԭ�Ӻ�ˮ�����е�Hԭ�����γ�������������ʾΪ
����4����ȩ��C��sp2�ӻ���C��H��C��H���н���������120�ȣ����������ʻ����ŶԵ��ӵ��ų⣬ʵ�ʼ���Ӧ����С��120�ȣ����Լ�ȩ������HCO�ļ��Ǵ���120�ȣ���ȩ�����е�Oԭ�Ӻ�ˮ�����е�Hԭ�����γ�������������ʾΪ 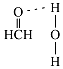 ��
��
���Դ��ǣ����ڣ� 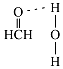 ����5���þ�����Nԭ�Ӹ�����4��Bԭ�Ӹ���=8��
����5���þ�����Nԭ�Ӹ�����4��Bԭ�Ӹ���=8�� ![]() +6��
+6�� ![]() =4����B��Nԭ�Ӹ���֮��Ϊ1��1��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ��
=4����B��Nԭ�Ӹ���֮��Ϊ1��1��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ�� ![]() ��
�� ![]() ��
�� ![]() ����
����
���Դ��ǣ�1��1���� ![]() ��
�� ![]() ��
�� ![]() ����
����

 ��У����ϵ�д�
��У����ϵ�д�