题目内容
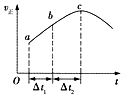
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )
A.前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(Lmin)
B.反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g)
C.若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g)
D.a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
【答案】A
【解析】由图可知0﹣10min平衡状态时,X曲线△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲线△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10min内用NO2表示的化学反应速率v(NO2)= ![]() =
= ![]() =0.04mol/(Lmin),A符合题意;
=0.04mol/(Lmin),A符合题意;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变,所以改变的条件可能是向容器中添加NO2(g),B不符合题意;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动来实现,C不符合题意;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态,根据图知,bd点各物质浓度不变,说明正逆反应速率相等,反应达到平衡状态,D不符合题意;
故答案为:A.
图像题一定要注意横轴与纵轴对应的物理量,结合化学定律进行分析。A.v(NO2)= ![]() 可由图像得出△ c 与 △ t;B.反应进行至25min时,c(NO2)突变而c(N2O4)不变是关键;C.因该反应的特点是反应物与生成物均为一种,加入反应物和加入生成物可达到相同的平衡状态;D.平衡状态时各物质浓度不变。
可由图像得出△ c 与 △ t;B.反应进行至25min时,c(NO2)突变而c(N2O4)不变是关键;C.因该反应的特点是反应物与生成物均为一种,加入反应物和加入生成物可达到相同的平衡状态;D.平衡状态时各物质浓度不变。

 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | P2 | P3 | |
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计).