题目内容
【题目】工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | P2 | P3 | |
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计).
【答案】
(1)![]() ,正向移动
,正向移动
(2)0mol/L<c(NH3)<0.3mol/L,0mol/L≤c(NH3)≤0.3mol/L
(3)92.4,=,>
(4)1.7
【解析】解:(1)由10amolH2和30amolN2放入2L的密闭容器中,充分反应后测得N2的转化率为60%,则
N2 + | 3H2 | 2NH3 | |
起始(mol/L) | 5a | 15a | 0 |
转化(mol/L) | 5a×60%=3a | 9a | 6a |
平衡(mol/L) | 2a | 6a | 6a |
平衡常数K= ![]() =
= ![]() =
= ![]() ;
;
若此时再向该容器中投入10amolN2、20amolH2和20amolNH3,三者的浓度分别为:7amol/L、16amol/L、16amol/L;则Q= ![]() =
= ![]() =
= ![]() <K,此时平衡正向进行;
<K,此时平衡正向进行;
故答案为: ![]() ;正向移动;
;正向移动;
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,假设反应正向进行,则N2的最大转化浓度为0.1mol/L,则NH3的变化浓度为0.2mol/L,即平衡时NH3的浓度小于0.3mol/L,假设反应逆向进行,则NH3的变化浓度最大为0.1mol/L,即平衡时NH3的最小浓度为大于0mol/L,故NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,如果反应是从反应物方向开始的,NH3的起始浓度为0mol/L,如果反应是生成物方向进行的,生成0.1mol/LN2时消耗NH3的浓度分别为0.05mol/L,NH3的起始浓度为0.15mol/L,NH3起始时浓度的范围为0mol/L≤c(NH3)≤0.3mol/L;
故答案为:0mol/L<c(NH3)<0.3mol/L;0mol/L≤c(NH3)≤0.3mol/L;
(3)甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,Q1+Q2=92.4;甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,所以转化率α1+α2=1;丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3;
故答案为:92.4;=;>;
(4)打开K2,一段时间又达到平衡时,等效为开始通入3molN2和9molH2再恒温恒容到达的平衡,与B中平衡为等效平衡,平衡时同种物质的转化率相等,则平衡时混合气体物质的量为B中平衡时的3倍,恒温恒压下体积之比等于物质的量之比,故平衡时气体体积为0.9 L×3=2.7L,则B的体积为2.7 L﹣1L=1.7L,
故答案为:1.7.
(1)利用三行式求平衡量,然后利用K值进行相差计算是化学平衡类题目常用的方法;(2)利用可逆反应的不彻底性确定物质的浓度范围;(3)利用等效平衡的思想比较不同条件下的平衡转化率;(4)由于气囊的作用关闭K2时B中为恒温恒压下进行的反应,联通后同样相当于恒温恒压下进行的反应,因此二者各物质的量呈正比关系。

【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol/L的硫酸,连接好装置(如图)后水浴加热至反应完全。
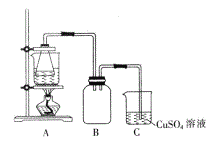
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________。
(3)装置C的作用是_____________。
(4)步骤④中洗涤时所用的洗涤剂最好是_____________。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后cmol/L的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
滴定过程中发生反应的离子方程式为________;产品的纯度为_________(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
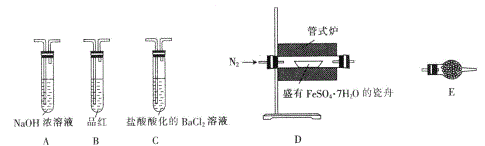
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (6)_____________ |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为_____________ |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)_____________ | (9)_____________ |



