题目内容
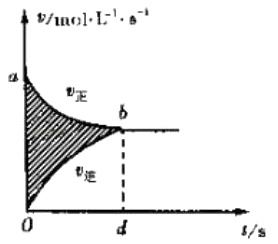
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )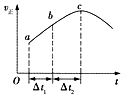
A.反应物的总能量低于生成物的总能量
B.△t1=△t2时,CO的转化率:a~b段小于bc段
C.反应在c点达到平衡状态
D.反应物浓度:a点小于b点
【答案】B
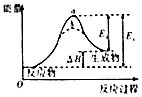
【解析】A.从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,A不符合题意;
B.着反应的进行,正反应速率越快,消耗的CO就越多,CO的转化率将逐渐增大,所以△t1=△t2时,CO的转化率:a~b段小于bc段,B符合题意;
C.a化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,C不符合题意;
D.随到b时正反应速率增加,反应物浓度随时间不断减小,所以反应物浓度:a点大于b点,D不符合题意;
故答案为:B.
A.影响速率的因素有多种,要从题目中确定C点前主要因素为温度;B,平衡前相同时间内速率越快,反应物的转化率越大;C.化学平衡状态的标志是各物质的浓度不再改变速率不再变化;D.平衡前反应物浓度随时间不断减小。

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目