题目内容
一定条件下,发生反应:①M(s)+N(g)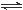 R(g) △H = -Q1 kJ·mol-1,②2R (g)+N(g)
R(g) △H = -Q1 kJ·mol-1,②2R (g)+N(g)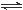 2T (g) △H = -Q2 kJ·mol-1。 Q1、Q2、Q3均为正值。下列说法正确的是
2T (g) △H = -Q2 kJ·mol-1。 Q1、Q2、Q3均为正值。下列说法正确的是
| A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 |
| B.将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ |
C.当1 mol M(s)完全转化为T (g)时(假定无热量损失),放出热量Q1+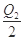 kJ kJ |
D.M(g)+N(g)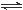 R(g) △H=-Q3 kJ·mol-1 , 则Q3<Q1 R(g) △H=-Q3 kJ·mol-1 , 则Q3<Q1 |
C
解析试题分析:A、反应①为放热反应,1 mol R(g)的能量总和小于1 mol M(s)与1 mol N(g) 的能量总和,错误; B、反应②为可逆反应,可逆反应不能进行到底,将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量小于Q2 kJ,错误;C、根据反应①、②,利用盖斯定律分析知,当1 mol M(s)完全转化为T (g)时(假定无热量损失),放出热量Q1+Q2/2kJ,正确;D、1 molM(g)具有的能量大于1 molM(s),结合反应①知,M(g)+N(g) R(g) △H=-Q3 kJ·mol-1 , 则Q3>Q1,错误。
R(g) △H=-Q3 kJ·mol-1 , 则Q3>Q1,错误。
考点:考查化学反应与能量变化。

练习册系列答案
相关题目
对于放热反应H2 + Cl2  2HCl,下列说法正确的是
2HCl,下列说法正确的是
| A.该反应涉及到了离子键和共价键的断裂与形成 |
| B.反应物所具有的总能量高于产物所具有的总能量 |
| C.断开1 mol H—H键和1 mol Cl—Cl键,所吸收的总能量,小于形成1 mol H—Cl键,所放出的能量 |
| D.该反应中,化学能只转变为热能 |
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,由此可判断( )
C(g)+D(g)过程中的能量变化如图所示,由此可判断( )
| A.1molA与1molB充分反应后,能量变化为ΔE |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
| A.该反应为放热反应 |
| B.催化剂能改变该反应的焓变 |
| C.催化剂能降低该反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
下列物质的变化过程中,化学键没有被破坏的是( )
| A.食盐溶解 | B.干冰升华 | C.氯化铵受热 | D.氯化钠熔融 |
生活中每时每刻都发生着各种化学反应,下列反应不一定属于放热反应的是( )
| A.硫酸和氢氧化钡溶液的反应 | B.燃烧反应 |
| C.复分解反应 | D.中和反应 |
白磷会对人体造成严重的烧伤,白磷(P4)分子结构为 。下列说法不正确的是
。下列说法不正确的是
| A.白磷着火点低,在空气中可自燃 |
| B.白磷、红磷互为同素异形体 |
| C.31 g白磷中,含P—P键1.5 mol |
| D.已知P4(白磷,s)+3O2(g)===2P2O3(s) ΔH=-Q kJ·mol-1,则白磷的燃烧热为Q kJ·mol-1 |
下列推论正确的是:
| A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2 |
| B.C(石墨,s)=C(金刚石,S)△H="+1.9" kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol |

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态