题目内容
对于放热反应H2 + Cl2  2HCl,下列说法正确的是
2HCl,下列说法正确的是
| A.该反应涉及到了离子键和共价键的断裂与形成 |
| B.反应物所具有的总能量高于产物所具有的总能量 |
| C.断开1 mol H—H键和1 mol Cl—Cl键,所吸收的总能量,小于形成1 mol H—Cl键,所放出的能量 |
| D.该反应中,化学能只转变为热能 |
B
解析试题分析:该反应只涉及了共价键的断裂和形成,A错误;该反应是放热反应,反应物所具有的总能量高于产物所具有的总能量,B正确;断开1 mol H—H键和1 mol Cl—Cl键,所吸收的总能量,大于形成1 mol H—Cl键,所放出的能量,C错误;该反应中,发出白色火焰,化学能转化为光能和热能,D错误。
考点:化学键、化学反应的实质、键能、化学反应的能量变化等相关知识。

练习册系列答案
相关题目
探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
化学反应A2 + B2 = 2AB的能量变化如图所示,则下列说法正确的是( )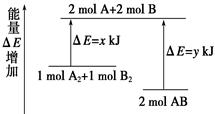
| A.该反应是吸热反应 |
| B.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量 |
| C.断裂2 mol A—B键需要吸收y kJ的能量 |
| D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片和稀硫酸反应 | B.Ba(OH)2?8H2O与NH4Cl反应 |
| C.灼热的炭与CO2反应 | D.甲烷在O2中燃烧 |
下列关于化学反应与能量的说法正确的是
| A.中和反应是吸热反应 |
| B.燃烧是放热反应 |
| C.化学键断裂放出能量 |
| D.反应物总能量与生成物总能量一定相等 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
一定条件下,发生反应:①M(s)+N(g)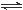 R(g) △H = -Q1 kJ·mol-1,②2R (g)+N(g)
R(g) △H = -Q1 kJ·mol-1,②2R (g)+N(g)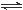 2T (g) △H = -Q2 kJ·mol-1。 Q1、Q2、Q3均为正值。下列说法正确的是
2T (g) △H = -Q2 kJ·mol-1。 Q1、Q2、Q3均为正值。下列说法正确的是
| A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 |
| B.将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ |
C.当1 mol M(s)完全转化为T (g)时(假定无热量损失),放出热量Q1+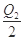 kJ kJ |
D.M(g)+N(g)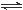 R(g) △H=-Q3 kJ·mol-1 , 则Q3<Q1 R(g) △H=-Q3 kJ·mol-1 , 则Q3<Q1 |
下列说法正确的是
| A.物质发生化学变化都伴随着能量变化 |
| B.任何反应中的能量变化都表现为热量变化 |
| C.物质变化时若伴有能量变化,则一定是化学变化 |
| D.没有物质的化学变化,也就没有能量的变化 |
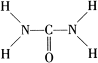 : 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
: 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。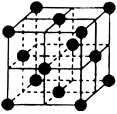
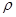 g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3