题目内容
 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:(1)根据上图,计算从反应开始到平衡时,氢气的平均反应速率v(H2)为
0.0375mol/(L.min)
0.0375mol/(L.min)
.(2)该反应达到平衡时N2的转化率
50%
50%
.(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a
a
.(填序号)a.0.20mol?L-1 b.0.12mol?L-1 c.0.10mol?L-1 d.0.08mol?L-1
(4)请写出该反应的平衡常数表达式
K=
| c2(NH3) |
| c(N2)×c3(H2) |
K=
,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1| c2(NH3) |
| c(N2)×c3(H2) |
>
>
K2(填“>”、“=”或“<”).(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
分析:(1)由图可知,达到平衡时氨气增加0.10mol/L,先计算其反应速率,再利用反应速率之比等于化学计量数之比来计算氢气的速率;
(2)由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,以此计算转化率;
(3)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应;
(4)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,该反应为放热反应,温度越大,平衡常数越小;
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol?L-1.
(2)由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,以此计算转化率;
(3)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应;
(4)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,该反应为放热反应,温度越大,平衡常数越小;
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol?L-1.
解答:解:(1)由图可知,达到平衡时氨气增加0.10mol/L,其反应速率为
=0.025mol/(L.min),
由利用反应速率之比等于化学计量数之比,则氢气的速率为
×0.025mol/(L.min)=0.0375mol/(L.min),
故答案为:0.0375mol/(L.min);
(2)由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,所以氮气的转化率为
×100%=50%,
故答案为:50%;
(3)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应,
所以0<c(NH3)<0.2mol/L,即NH3的物质的量浓度不可能为0.2mol/L,故答案为:a;
(4)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,则K=
,该反应为放热反应,温度越大,平衡常数越小,
反应在298K、398K时的化学平衡常数分别为K1、K2,所以K1>K2,故答案为:K=
;>;
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol?L-1,
则图象为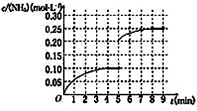 ,故答案为:
,故答案为: .
.
| 0.10mol/L |
| 4min |
由利用反应速率之比等于化学计量数之比,则氢气的速率为
| 3 |
| 2 |
故答案为:0.0375mol/(L.min);
(2)由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,所以氮气的转化率为
| 0.1mol |
| 0.2mol |
故答案为:50%;
(3)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应,
所以0<c(NH3)<0.2mol/L,即NH3的物质的量浓度不可能为0.2mol/L,故答案为:a;
(4)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,则K=
| c2(NH3) |
| c(N2)×c3(H2) |
反应在298K、398K时的化学平衡常数分别为K1、K2,所以K1>K2,故答案为:K=
| c2(NH3) |
| c(N2)×c3(H2) |
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol?L-1,
则图象为
 ,故答案为:
,故答案为: .
.点评:本题考查化学平衡的计算,明确反应速率计算、平衡的影响因素及图象的分析试剂解答本题的关键,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
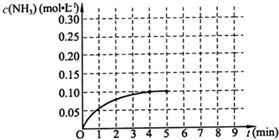

 2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:
2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:

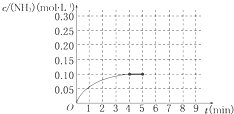 在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示: