题目内容
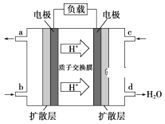
【题目】一种微生物燃料电池如图所示,下列关于该电池说法正确的是

A.a电极发生还原反应,做原电池的正极
B.b电极反应式为:2NO3-+10e-+12H+=N2↑+6H2O
C.H+由右室通过质子交换膜进入左室
D.标准状况下,电路中产生6moLCO2同时产生22.4L的N2
【答案】B
【解析】
试题分析:在该燃料电池中通入燃料的电极为负极,故电极a为负极,则电极b为正极。A、a电极为负极,发生氧化反应,A错误;B、b电极为正极,发生还原反应,反应式为:2NO3-+10e-+12H+=N2↑+6H2O,B正确;C、溶液中H+由负极移向正极,即由左室通过质子交换膜进入右室,C错误;D、不能确定微生物中碳元素的化合价,则不能计算转移的电子数,所以不能通过二氧化碳计算氮气的体积,D错误;答案选B。

 小题狂做系列答案
小题狂做系列答案【题目】工业制硝酸的主要反应为4NH3(g)+5O2(g)4NO(g)+6H2O(l)△H
(1)已知:氢气的燃烧热为285.8kJmol-1
N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1
N2(g)+O2(g)2NO(g)△H=+180.6kJmol-1
则上述工业制硝酸的主要反应的△H=______。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 | c(NH3)(molL-1) | c(O2)(molL-1) | c(NO)(molL-1) |
起始 | 0.8 | 1.6 | 0 |
第2min | 0.6 | a | 0.2 |
第4min | 0.3 | 0.975 | 0.5 |
第6min | 0.3 | 0.975 | 0.5 |
第8min | 0.7 | 1.475 | 0.1 |
①反应在第2min到第4min内,O2的平均反应速率为______。
②反应在第6min时改变了条件,改变的条件可能是______(填序号)。
A 使用催化剂 B 升高温度C 减小压强D 增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)4NO(g)+6H2O(g)达到平衡状态的是_____(填序号)。
A 单位时间内生成nmolNO的同时,生成nmolNH3
B 条件一定,混合气体的平均相对分子质量不再变化
C 百分含量w(NH3)=w(NO)
D 反应速率v(NH3)∶v(O2) ∶v(NO) ∶v(H2O)=4∶5∶4∶6
E 若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。
①该电池工作时,b口通入的物质为______。
②该电池正极的电极反应式为______。