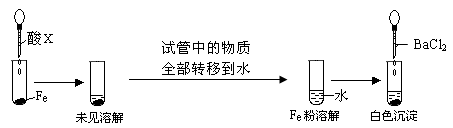
题目内容
在8.08g铁与铜的混和物中,加入200mL 0.6mol/L的稀硝酸,充分反应后剩余金属5.44g。再向其中加入50mL 0.4mol/L的稀硫酸,充分振荡后剩余金属4.48g。若硝酸的还原产物只有NO,下列说法正确的是
| A.剩余的5.44g金属为铁 | B.剩余5.44g金属为铜 |
| C.共生成NO气体 0.03mol | D.8.08g金属中铁的质量分数为0.208 |
BD
解析试题分析:每次均有金属剩余,说明反应后溶液中肯定没有Fe3+,肯定有Fe2+;
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
3 8 2
3Fe + 8H+ + 2NO3- = 3Fe2+ + 2NO↑ + 4H2O
3 8 2
第一次加入H+和NO3-均为:0.2L × 0.6mol/L = 0.12mol,而有金属剩余,知道反应后溶液中必然不含H+,而NO3-只有1/4被还原:0.12mol × 1/4 = 0.03mol。设溶解Cu为xmol,溶解Fe为ymol,则:xmol + ymol =" 3/8" × 0.12mol;且 64g/mol × xmol + 56g/mol × ymol =" 8.08g" - 5.44g = 2.64g。解这个方程组,得:x = 0.015,y = 0.03。第二次又加入H+为:0.05L × 0.4mol/L × 2 = 0.04mol,从方程式看出又有0.01mol的NO3-进一步被还原。而如果金属全部消耗的是Fe,则金属必然减少:56g/mol × 3/8 × 0.04mol =" 0.84g" < 5.44g - 4.48g = 0.96g;而如果金属消耗的都是Cu,则金属减少:64g/mol × 3/8 × 0.02mol =" 0.96g" =" 5.44g" - 4.48g = 0.96g。说明消耗的只有Cu。则可知第一次反应后剩余的5.44g金属全部是Cu。综合以上计算,可知原混合物中含Cu:0.015mol × 64g/mol + 5.44g = 6.4g,含Fe为:0.03mol × 56g/mol = 1.68g,原混合物中金属铁的质量分数为:1.68g ÷ 8.08g × 100% = 20.8%。共生成NO为:0.03mol + 0.01mol = 0.04mol。答案选B、D。
考点:考查化学方程式及相关计算。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案“84”消毒液在日常生活中使用广泛。该消毒液无色,有漂白作用。它的有效成分是
A.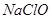 | B.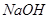 | C.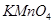 | D.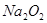 |
下列物质中,分别加入少量溴水,振荡后静置,水溶液呈无色的是
| A.NaOH溶液 | B.NaCl溶液 | C.KI溶液 | D.四氯化碳 |
漂粉精常用于消毒游泳池中的水。有关漂粉精的叙述不正确的是
| A.生产原料是消石灰和氯气 | B.不宜长久储存 |
| C.有腐蚀及漂白作用 | D.消毒后无残渣,不会堵塞管道 |
硫的熔点是112.8℃,沸点是444.6℃。下列有关化学反应的事实描述错误的是
| A.硫蒸气能跟氢气直接化合,硅和磷则不能 |
| B.硫蒸气能跟铜直接化合生成黑色的Cu2S |
| C.硫粉和汞即使不加热也能发生反应生成黑色的Hg2S |
| D.铁粉和硫粉混合加热发生反应后即使移去热源后反应还能继续 |
下列是有关物质的性质或用途的说法中正确的是
① 氯气具有漂白性,可以直接使有色布条褪色;② 二氧化硫具有较强的还原性,不能用浓硫酸干燥;③ SiO2是酸性氧化物,能与氢氟酸反应;④ Al(OH)3是两性氢氧化物,能溶于强酸或强碱。
| A.①②③ | B.②③④ | C.③④ | D.①②④ |
氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述正确的是
| A.“两水”都是混合物,溶液中含有的粒子种类、数目相同 |
| B.“两水”中都存在可逆反应的化学平衡和弱电解质的电离平衡 |
| C.“两水”都有刺激性气味,都能漂白有机色素 |
| D.“两水”放置时间较久后都会因为相同的原理而变质 |