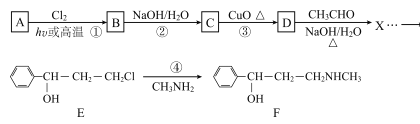
题目内容
【题目】碲(Te)及其化合物有许多优良性能,被广泛用于冶金、化工等领域。
(1)碲(Te)在周期表中的位置为________________________。碲化氢的还原性比H2S的还原性__________(填“强”或“弱”)。
(2)已知25℃时,亚碲酸(H2TeO3)的电离平衡常数:Ka1=1×10—3,Ka2=2×10—8。
①0.1mol/L H2TeO3溶液中H2TeO3的电离度约为__________;
②已知NaHTeO3的水溶液呈酸性,溶液中所有离子浓度大小顺序为____________________。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含Cu2Te,还含少量Ag、Au)为原料制备单质碲,其工艺流程如图:
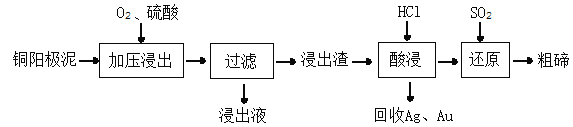
①已知浸出渣的主要成分是TeO2。写出“加压浸出”过程中的离子方程式________________________,该过程中,应控制溶液的pH为4.5~5.0,酸性不能太强的原因是__________________________。
②“酸浸”后将SO2通入浸出液即可制得单质碲,写出生成单质碲的化学方程式______________________。
③工业上还可以将铜阳极泥煅烧生成TeO2,然后碱浸,过滤,再对滤液进行电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为_______________________。
【答案】 第五周期第ⅥA族 强 10% c(Na+)>c(HTeO3—)>c(H+)>c(TeO32—)>c(OH—) Cu2Te+2O2+4H+=TeO2+2Cu2++2H2O TeO2会与酸反应导致Te元素损失 TeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4 TeO32—+4e—+3H2O=Te+6OH—
【解析】(1). 碲是52号元素,位于元素周期表的第五周期第ⅥA族,碲和硫元素位于同一主族,碲元素的非金属性小于硫,所以碲化氢的还原性比H2S的还原性强,故答案为:第五周期第ⅥA族;强;
(2). ①.亚碲酸(H2TeO3)是二元弱酸,0.1mol/L H2TeO3的电离度可以依据第一步电离计算,亚碲酸(H2TeO3)的Ka1=1×103,第一步电离方程式为:H2TeO3H++HTeO3,设c(H+)=xmol/L,则Ka1=![]() =
=![]() =1×103,解得x≈0.01mol/L,则H2TeO3的电离度为:
=1×103,解得x≈0.01mol/L,则H2TeO3的电离度为:![]() ×100%=10%,故答案为:10%;
×100%=10%,故答案为:10%;
②. HTeO3既可以水解也可以电离,则c(Na+)>c(HTeO3-),已知NaHTeO3的水溶液呈酸性,说明HTeO3的电离程度大于水解程度,则c(HTeO3-)>c(H+)>c(TeO32-)>c(OH-),溶液中所有离子浓度大小顺序为:c(Na+)>c(HTeO3-)>c(H+)>c(TeO32-)>c(OH-),故答案为:c(Na+)>c(HTeO3-)>c(H+)>c(TeO32-)>c(OH-);
(3).①.TeO2微溶于水,易溶于较浓的强酸和强碱,说明TeO2是两性氧化物,“加压浸出”过程中Cu2Te被氧气氧化生成铜离子和TeO2,离子方程式为:Cu2Te+2O2+4H+=TeO2+2Cu2++2H2O,因为TeO2是两性氧化物,若H2SO4过量造成溶液酸性太强,会导致TeO2继续与H2SO4反应导致损失,故答案为:Cu2Te+2O2+4H+=TeO2+2Cu2++2H2O;TeO2会与酸反应导致Te元素损失;
②. SO2将TeCl4还原为Te,自身被氧化为硫酸,根据得失电子守恒和原子守恒,该反应的化学方程式为:TeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4,故答案为:TeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4;
③. 将铜阳极泥煅烧生成TeO2,然后碱浸,过滤,所得滤液是Na2TeO3的溶液,用惰性电极电解溶液,在阴极上TeO32-得到电子生成Te,电极反应式为:TeO32-+4e-+3H2O=Te+6OH-,故答案为:TeO32-+4e-+3H2O=Te+6OH-。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为:________。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团:_______________________。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式_____________。 | |