题目内容
多晶硅生产工艺流程如下:
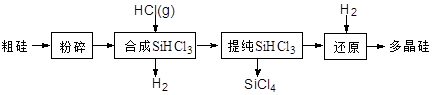
(1)粗硅粉碎的目的是 。分离SiHCl3 (l)和SiCl4(l)的方法为 。
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3 (g)+ H2 (g)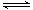 Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
(3)该流程中可以循环使用的物质是 。
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为 。

(1)粗硅粉碎的目的是 。分离SiHCl3 (l)和SiCl4(l)的方法为 。
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3 (g)+ H2 (g)
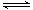 Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。(3)该流程中可以循环使用的物质是 。
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为 。
(1)增大接触面积,加快反应速率,充分反应(2分) 蒸馏(2分)
(2)K=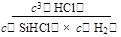 (3分) 升高温度或增大氢气与 SiHC13的物质的量之比或增大氢气浓度(2分)
(3分) 升高温度或增大氢气与 SiHC13的物质的量之比或增大氢气浓度(2分)
(3)HCl、H2(2分)
(4)3SiCl4+Si+2H2=4SiHCl3(2分)
(2)K=
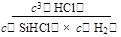 (3分) 升高温度或增大氢气与 SiHC13的物质的量之比或增大氢气浓度(2分)
(3分) 升高温度或增大氢气与 SiHC13的物质的量之比或增大氢气浓度(2分)(3)HCl、H2(2分)
(4)3SiCl4+Si+2H2=4SiHCl3(2分)
试题分析: (1)粗硅粉碎长大了表面积,加快反应速率;SiHCl3和SiCl4均为液态而且互相溶解,根们沸点不同,用蒸馏法分离。
(2)Si为固态,表达式中无Si,使平衡向正反应方向移动,能提高还原时SiHCl3的转化率。
(3))HCl、H2在流程中分别作反应物和生成物,所以可循环使用。
(4)结合流程,对比SiHCl3和SiCl4,可得出反应物还有和H2和Cl2,然后写出化学方程式。

练习册系列答案
相关题目

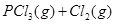 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
 ,则反应的
,则反应的
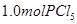 、
、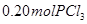 和
和 ,达到平衡前v(正)>v(逆)
,达到平衡前v(正)>v(逆)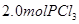 、
、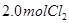 ,达到平衡时,
,达到平衡时,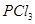 的转化率小于80%
的转化率小于80% 2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: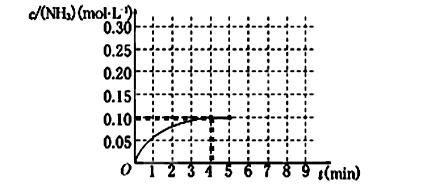
 2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是( )
2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是( ) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率( υ)一时间(t)图象如下图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率( υ)一时间(t)图象如下图。则下列说法中正确的是 
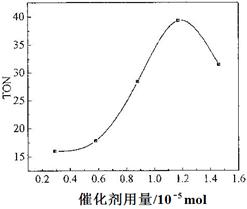
 CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( )
CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( )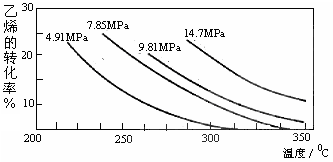
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。 CH3OH(g).
CH3OH(g).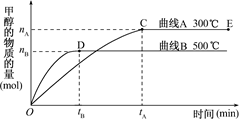
 cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: