题目内容
【题目】将4molN2O4放入2L恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(Φ)随温度的变化如图所示:
2NO2(g),平衡体系中N2O4的体积分数(Φ)随温度的变化如图所示:
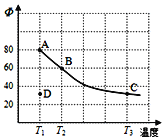
(1)D点v(正)____v(逆)(填“>、<或=”)。
(2)A、B、C三点中平衡常数K的值最大的是____点。T2时N2O4的平衡转化率为____;若平衡时间为5s,则此时间内的N2O4平均反应速率为____。
(3)若其条件不变,在T3原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数____(填“增大、不变或减小”)。
【答案】< C 25% 0.1mol·L—1·s—1 减小
【解析】
(1)T1温度下,D点到平衡点A,N2O4的体积分数增大,反应逆向进行,所以v(正)<v(逆);
(2)根据图示,升高温度平衡体系中N2O4的体积分数减小,平衡正向移动,升高温度,平衡常数增大,A、B、C点中平衡常数K的值最大的是C点;

![]() ,x=0.5,T2时N2O4的平衡转化率为
,x=0.5,T2时N2O4的平衡转化率为![]() ;若平衡时间为5s,则此时间内的N2O4平均反应速率为
;若平衡时间为5s,则此时间内的N2O4平均反应速率为![]() 0.1mol·L-1·s-1;
0.1mol·L-1·s-1;
(3)若其条件不变,在T3原平衡基础上,再加入一定量NO2,相当于加压,平衡逆向移动,NO2的体积分数减小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表的一部分,回答问题:
① | |||||||
② | |||||||
③ | ④ | ⑤ | |||||
⑥ |
(1)①和②形成的最简单化合物的结构式是__________,该分子的空间构型是________。
(2)⑤元素位于元素周期表 ___ ,最外层电子的排布式 _________ ,原子核外有 _______种能量不同的电子。CCl4 是一种常见的有机溶剂,判断其属于 _______ (填“极性”、“非极性”)共价键,_________ 分子(填“极性”、“非极性”)。
(3)某元素3P亚层上只有一个电子,判断其离子与②,⑤离子半径大小 ______ (用微粒符号表示),写出该元素单质与元素③最高价氧化物对应水合物反应的化学方程式:________。
(4)设计一个实验方法:比较⑤与⑥单质氧化性的强弱,填入下表。
实验步骤 | ________ |
实验现象 | ________ |
实验原理 | ________ |
实验结论 | ________ |
【题目】矿物斜长石(主要成份为KAlSi3O8)在一定温度范围内用氯化钠熔浸可制得氯化钾,反应原理是NaCl(l)+KAlSi3O8(s)![]() KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯原子最外层的电子排布式___;氧原子核外电子的轨道式___;铝原子核外有___种不同能量的电子。
(2)上述反应涉及的元素中,原子半径最大的是___。该反应中位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是___;从原子结构方面去分析钠元素的金属性强于铝元素的原因是___。
(3)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行对照实验(保持其它条件不变),获得如下数据:
时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ― |
①分析以上数据可以得出,氯化钠熔浸钾长石是___(填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是___(选填编号)。
a.充分搅拌 b.延长反应时间
c.增大反应体系的压强 d.将钾长石粉粹成更小的颗粒
(2)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)![]() NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?___,(填“能说明”或“不能说明”)原因是___。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?___,(填“能说明”或“不能说明”)原因是___。
【题目】下表是元素周期表的一部分,表中的字母分别代表一种化学元素。
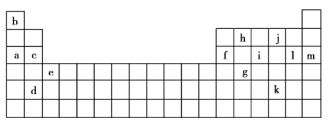
(1)a和c的I1大小关系是______大于______。(填字母)
(2)上述元素中,原子中未成对电子数最多的是______(填字母),写出该元素基态原子的核外电子排布式:______。
(3)根据下表所提供的电离能数据,回答下列问题。
锂 | X | Y | |
I1 | 520 | 496 | 580 |
I2 | 7296 | 4570 | 1820 |
I3 | 11799 | 6920 | 2750 |
I4 | 9550 | 11600 |
①表中X可能为以上13种元素中的______(填字母)元素。用元素符号表示![]() 和j形成的一种化合物的化学式:______。
和j形成的一种化合物的化学式:______。
②Y是周期表中第______族元素。
③以上13种元素中,______(填字母)元素原子失去核外第一个电子需要的能量最多。