题目内容
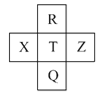
【题目】下表是元素周期表的一部分,表中的字母分别代表一种化学元素。
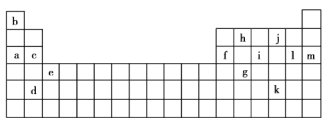
(1)a和c的I1大小关系是______大于______。(填字母)
(2)上述元素中,原子中未成对电子数最多的是______(填字母),写出该元素基态原子的核外电子排布式:______。
(3)根据下表所提供的电离能数据,回答下列问题。
锂 | X | Y | |
I1 | 520 | 496 | 580 |
I2 | 7296 | 4570 | 1820 |
I3 | 11799 | 6920 | 2750 |
I4 | 9550 | 11600 |
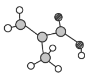
①表中X可能为以上13种元素中的______(填字母)元素。用元素符号表示![]() 和j形成的一种化合物的化学式:______。
和j形成的一种化合物的化学式:______。
②Y是周期表中第______族元素。
③以上13种元素中,______(填字母)元素原子失去核外第一个电子需要的能量最多。
【答案】c a i ![]() (或[Ne]3s23p3) a
(或[Ne]3s23p3) a ![]() (或Na2O2) ⅢA m
(或Na2O2) ⅢA m
【解析】
由元素在周期表中位置,可知a为Na、b为H、c为Mg、d为Sr、e为Sc、f为Al、g为Ge、h为C、i为P、j为O、k为Te、l为Cl、m为Ar,据此结合元素的核外排布与第一电离能的变化规律解答。
根据上述分析可知,
(1)a为Na,c为Mg,两者均属于属于第三周期,因同一周期中,元素原子的第一电离能随原子序数的增加呈增大趋势,故第一电离能I1:Mg大于Na,即为c大于a;
(2)i元素最外层电子排布为3s23p3,有3个未成对电子,未成对电子最多,核外电子排布式为1s22s22p63s23p3(或[Ne]3s23p3),
故答案为:i;1s22s22p63s23p3(或[Ne]3s23p3);
(3)①由表中数据可以看出,锂和X的I1均比I2、I3小很多,说明X与Li同主族,且X的I1比Li的I1更小,说明X的金属性比锂更强,则X为Na,X和j形成的化合物的化学式为Na2O、Na2O2,
故答案为:a;Na2O(或Na2O2);
②由Y的电离能数据可以看出,它的I1、I2、I3比I4小得多,故Y原子属于ⅢA族元素,
故答案为:ⅢA;
③以上13种元素中,Ar属于第三周期,原子最稳定的是Ar,故其I1最大,即元素原子失去核外第一个电子需要的能量最多,故答案为:m。