题目内容
1.设NA为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 常温常压下,22.4 L乙烯中含C-H键的数目为4NA | |
| B. | 1molFe与足量盐酸反应转移电子数为3NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有的氧原子数目为0.1NA | |
| D. | 向1L 1 mol•L-1氯化铝溶液中加入足量的氨水,生成AlO2-的个数为NA |
分析 A.常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算;
B.铁与盐酸反应生成氯化亚铁,1mol铁完全反应转移2mol电子;
C.氧气和臭氧分子中都只含有氧原子,1.6g混合物中含有1.6g氧原子,含有0.1mol氧原子;
D.氨水为弱碱,氯化铝与氨水反应生成氢氧化铝沉淀,不会生成偏铝酸根离子.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算22.4L乙烯的物质的量,故A错误;
B.1mol铁与足量盐酸反应生成1mol氯化亚铁,失去了2mol电子,反应转移电子数为2NA,故B错误;
C.1.6g由氧气和臭氧组成的混合物中含有1.6g氧原子,含有氧原子的物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol,含有的氧原子数目为0.1NA,故C正确;
D.氨水为弱碱,氯化铝与氨水反应生成产物为氢氧化铝沉淀,不会生成偏铝酸根离子,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、物质的量浓度、摩尔质量等物理量之间的转化关系,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.据统计,陕西省的机动车保有量每年以15%至20%的速度增长,汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.4mol,则下列判断正确的是( )
| A. | 生成22.4LN2(标准状况) | B. | 有0.25molKNO3被氧化 | ||
| C. | 转移电子的物质的量为0.5mol | D. | 被氧化的N原子的物质的量为3mol |
12.一定条件下,氨气与氟气发生反应:4NH3+3F2═NF3+3NH4F,其中NF3分子构型与NH3相似.下列有关说法错误的是( )
| A. | NF3是极性分子 | |
| B. | NF3既是氧化产物,又是还原产物 | |
| C. | NH4F中既含有离子键又含有共价键 | |
| D. | 上述反应中,反应物和生成物均属于分子晶体 |
9.下列有关物质性质的应用错误的是( )
| A. | 明矾水解生成Al(OH)3胶体,用作净水剂 | |
| B. | SO2具有漂白性,常用来漂白纸浆 | |
| C. | 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污 | |
| D. | 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 |
13. 铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
 铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )| A. | 放电时负极反应是:Pb-2e-═Pb2+,充电是阴极反应是:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| B. | 闭合K断开K1,电流的流动方向是从B到A | |
| C. | 放电过程中,溶液的pH不断减小 | |
| D. | 放电时,线路上若有1mole-通过,则消耗硫酸也是1mol |
10.全氟丙烷(C3F8)是一种比二氧化碳有效104倍的“超级温室气体”.有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: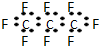 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子中既有极性键又有非极性键 |
11.下列过程或变化一定吸收能量的是( )
| A. | 断裂化学键 | B. | 形成化学键 | C. | 化合反应 | D. | 分解反应 |
 .
.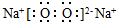 ,所含化学键类型为离子键、共价键.
,所含化学键类型为离子键、共价键.