题目内容
【题目】燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为NH4+。下列说法正确的是
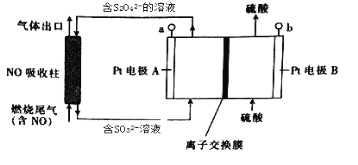
A. a连接电源的正极
B. Pt电极B上发生的电极反应为2H2O-4eˉ=O2↑+4H+
C. 当NO吸收柱中产生1mol SO32ˉ时,理论上处理的NO气体的体积为8.96L(标准状况)
D. 图中的离子交换膜应为阴离子交换膜
【答案】B
【解析】
根据图示,SO32ˉ在电极A上反应生成S2O42ˉ,反应中S元素的化合价由+4价变成+3价,化合价降低被还原,因此A为阴极,则B为阳极,在NO吸收柱中NO与S2O42ˉ反应生成氮气和SO32ˉ,据此分析解答。
A. 根据上述分析,A为阴极,B为阳极,a连接电源的负极,故A错误;
B. Pt电极B为阳极,发生氧化反应,电极反应为2H2O-4eˉ=O2↑+4H+,故B正确;
C. 当NO吸收柱中产生1mol SO32ˉ时,反应中消耗0.05molS2O42ˉ,转移1mol电子,根据得失电子守恒,处理的NO气体为0.5mol,标准状况下的体积为11.2L,故C错误;
D. 根据图示,阳极区硫酸的浓度基本不变,结合电极B的反应为2H2O-4eˉ=O2↑+4H+,生成的氢离子需要向阴极区运动,离子交换膜应为阳离子交换膜,故D错误;故选B。

练习册系列答案
相关题目




