题目内容
【题目】Cu、Ni、V为制造合金及合成催化剂的重要元素。请回答:
(1)基态铜原子的电子排布式是_________________。基态铜原子价电子层排布依据的原理,可用于解释下列事实的是___________。
A.Fe2+易被氧化为Fe3+ B.铜丝灼烧时焰色呈绿色
C.N的第一电离能大于O的第一电离能 D.NaCl的熔点比KCl的高
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________(任写一种)。NH3与CH4的VSPER构型相同,其中NH3的键角较小,原因是____________。Ni(CO)4中σ键和π键的数目之比为_________。
(3)钒的某种配合物有增强胰岛素和降糖作用,其分子结构如图所示。
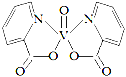
① 基态V元素的价层电子轨道表示式______________________,分子中非金属元素电负性由大到小的顺序为________。
② 该物质的晶体中除配位键外,所含微粒间作用力的类型还有___________(填序号)。
a.金属键 b.极性键 c.非极性键 d.范德华力 e.氢键
③ 1mol分子中含有配位键的数目是______,分子中采取sp2杂化的原子有_______。
【答案】 1s22s22p63s23p63d104s1(或[Ar] 3d104s1) AC CCl4、SiCl4、CBr4、SiF4等任写一种 NH3分子中N原子有孤对电子,孤对电子对成键电子有较大的斥力,使NH3键角减小 1:1 ![]() O、N、C、H bcd 2NA N、C
O、N、C、H bcd 2NA N、C
【解析】铜的原子序数为29,基态铜原子的电子排布式是1s22s22p63s23p63d104s1;Fe2+的价电子3d6失去一个电子可形成3d5半充满稳定结构,与价电子层排布有关,A正确;铜丝灼烧时焰色呈绿色,是因原子外层电子吸收能量,跃迁到激发态,当电子跃迁回基态时,会放出能量,这种能量以光的形势释放,不同的元素其跃迁的轨道不同,释放的能量的大小也不同,而能级差决定了释放出的光的频率,即决定了光的颜色,与价电子层排布无关,B错误;N原子2p能级半充满,稳定性强,所以氮元素的第一电离能大于氧元素的,与价电子层排布有关,C正确;由于二者都是相同的阴离子,对于钠离子而言,其外层电子有三层,而钾离子有四层,层数越多,质子对最外层电子的束缚能力越弱,而正是最外的这一层电子参与了晶键的形成,因此同钠离子比较,钾离子束缚力弱,在较低的温度下其外层电子即可游离,故NaCl的熔点比KCl的高,与价电子层排布无关,D错误;正确答案:1s22s22p63s23p63d104s1(或[Ar] 3d104s1);AC。
(2) 与SO42-互为等电子体的分子可以采用“左右移位,同族替换”的方法寻找:CCl4、SiCl4、CBr4、SiF4等任意一种;NH3与CH4的VSPER构型相同,其中NH3的键角较小,原因是NH3分子中N原子有孤对电子,孤对电子对成键电子有较大的斥力,使NH3键角减小;4分子一氧化碳,每分子中C与O成一个σ键,C的孤对电子与Ni的空轨道成一个配位键,所以一个Ni(CO)4中含8个σ键;每分子中C与O成2个π键,4分子的一氧化碳含有8个π键,所以Ni(CO)4中σ键和π键的数目之比为1:1;正确答案:CCl4、SiCl4、CBr4、SiF4等任写一种;NH3分子中N原子有孤对电子,孤对电子对成键电子有较大的斥力,使NH3键角减小;1:1。
(3)①基态V元素的价层电子排布式为![]() ,轨道表示式为
,轨道表示式为![]() ;同周期自左而右电负性增大,非金属性越强,电负性越大,故电负性:O、N、C、H依次减小;正确答案是:
;同周期自左而右电负性增大,非金属性越强,电负性越大,故电负性:O、N、C、H依次减小;正确答案是:![]() ;O、N、C、H;
;O、N、C、H;
②该物质的晶体中除配位键外,分子之间存在范德华力,分子内不同原子之间形成极性键、同种原子之间形成非极性键,不存在金属键与氢键;正确答案:bcd。
③分子中C原子、N原子![]() 键均为3,均没有孤电子对,杂化轨道数目均为3,均采取
键均为3,均没有孤电子对,杂化轨道数目均为3,均采取![]() 杂化,V与N原子之间形成配位键,1mol分子含有2mol配位键,即含有2NA 个配位键;正确答案C、N;2NA。
杂化,V与N原子之间形成配位键,1mol分子含有2mol配位键,即含有2NA 个配位键;正确答案C、N;2NA。



