题目内容
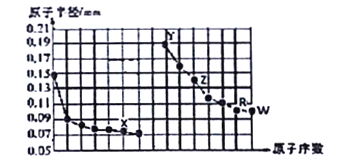
【题目】二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25s内的反应进程.
(1)前20秒内O2的平均生成速率:mol/(Ls)
(2)在某温度下达到平衡后,不改变其他条件,向该容器中再加入少量的NO2 , 平衡移动的方向是 , NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)
【答案】
(1)5.5×10﹣4
(2)正向,<,减小
【解析】解:(1)由图可知,20秒内NO2的浓度变化为0.04mol/L﹣0.018mol/L=0.022mol/L,故v(NO2) ![]() =0.0011mol/(Ls),对于2NO22NO+O2,速率之比等于化学计量数之比,所以v(O2)=
=0.0011mol/(Ls),对于2NO22NO+O2,速率之比等于化学计量数之比,所以v(O2)= ![]() v(NO2)=
v(NO2)= ![]() ×0.0011mol/(Ls)=5.5×10﹣4mol/(Ls),
×0.0011mol/(Ls)=5.5×10﹣4mol/(Ls),
所以答案是:5.5×10﹣4;
(2)在某温度下达到平衡后,不改变其他条件,向该容器中再加入少量的NO2,二氧化氮浓度增大,平衡正向移动,但二氧化氮转化的增加量小于加入的增加量,所以二氧化氮转化率降低,小于68.75%,NO的物质的量增大,但NO物质的量增大量小于容器中增加的物质的量,所以NO的体积百分含量减小,
所以答案是:正向;<;减小.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】某同学欲用物质的量浓度为0.100 0molL﹣1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液 , 立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是(填序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若某次滴定结束时,酸式滴定管中的液面如图所示,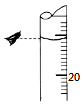
则读数为 mL.若仰视,会使读数偏(填“大”或“小”).
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是 molL﹣1 .
滴定 | 待测溶液 | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | 1.34 | 19.39 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
【题目】根据问题填空:
(1)CO(g)+2H2(g)CH3OH(g)△H
如表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”).能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变 C.混合气体的相对分子质量 D.c(CO)=c(CH3OH)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=(保留3为有效数字)
(2)在某温度和压强下,将一定量H2和O2充入密闭容器发生反应:
2H2(g)+O2(g)2H2O(g)△H=﹣241.8KJ/mol,平衡后压缩容器体积至原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填序号):
,其他条件不变,对平衡体系产生的影响是 (填序号):
a.平衡常数K增大; b.正反应速率加快,逆反应速率减慢; c.重新平衡c(H2)/c(H2O)减小.